
【題目】工業上,利用冶鉛廢料(含有Pb、PbO、PbS、PbCO3、Pb(OH)2、C以及Fe及其氧化物等)制取立德粉(ZnS·BaSO4)和再提取鉛的工藝流程如下:
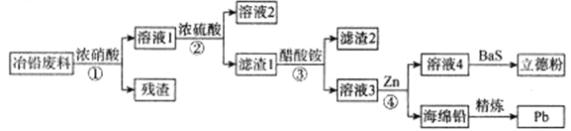
已知:
①醋酸鉛易溶于水,難電離。
②常溫下,Ksp(PbSO4)=1.6×10-8;Ksp(PbCO3)=8.0×10-14。
回答下列問題:
(1)為了加快①的反應速率,通常選用6mol/L的硝酸和60℃的反應條件,若溫度繼續升高,反而不利于反應的進行,原因可能是___________。
(2)步驟④若在實驗室進行分離操作必需的玻璃儀器有___________,濾渣1的主要成分是硫酸鉛,洗滌硫酸鉛最好選用___________。
A.蒸餾水 B.苯 C.稀硫酸 D.飽和碳酸鈉
(3)寫出步驟③反應的離子方程式___________。
(4)采用電解法精煉鉛,海綿鉛連接電源的___________極(填正、負),生成鉛的電極反應式為___________。
(5)處理含鉛廢料1t(含鉛以PbO計,質量分數為11.15%),若回收率為90%,則得到的鉛質量___________g。
【答案】溫度過高,硝酸易分解 漏斗、燒杯、玻璃棒 C PbSO4+2CH3COO-=(CH3COO)2Pb+SO42- 正極 Pb2++2e-=Pb 9.315×104
【解析】
(1)通常選用6mol/L的硝酸和60℃的反應條件,溫度過高,硝酸易分解。
(2)步驟④反應后的分離操作是過濾,選漏斗、燒杯、玻璃棒;洗滌硫酸鉛要洗去表面吸附的雜質,還要減少損失,最好選用稀硫酸。
(3)步驟③反應的離子方程式PbSO4和CH3COO-作用生成易溶于水、難電離的(CH3COO)2Pb。
(4)采用電解法精煉鉛,海綿鉛連接電源的正極,鉛元素化合價升高;生成鉛的電極反應式:Pb2++2e-=Pb
(5)根據鉛守恒計算。
(1)硝酸受熱易分解,故溫度不能太高;
(2)步驟④反應后的分離操作為過濾,過濾所需的玻璃儀器有:燒杯、漏斗和玻璃棒;洗滌硫酸鉛要洗去表面吸附的雜質,還要減少損失,故A.會造成硫酸鉛部分溶解;B.可溶性離子不能溶解,不能洗去;C.稀硫酸能夠洗去雜質,同時可減少硫酸鉛的溶解;D.依題意,硫酸鉛易轉化為碳酸鉛,引入雜質。故選C;
(3)依題意醋酸鉛易溶于水、難電離,故反應的離子方程式為PbSO4+2CH3COO-=(CH3COO)2Pb+SO42-。
(4)采用電解法精煉鉛,海綿鉛連接電源的正極,鉛元素化合價升高;生成鉛的電極反應式:Pb2++2e-=Pb。
(5)根據鉛元素守恒可得為![]() =9.315×104g。
=9.315×104g。


科目:高中化學 來源: 題型:
【題目】SiO2廣泛存在自然界中,其用途也非常廣泛,可用于制造光導纖維,也用于生產半導體材料硅。
(1)寫出工業上制備粗硅的化學反應方程式_________________。
(2)SiO2耐腐蝕,但易溶于氫氟酸,寫出化學反應方程式: ______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為分析某鹽的成分, 做了如下實驗:
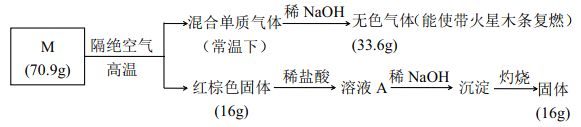
請回答:
(1)鹽 M 的化學式是_________;
(2)被 NaOH 吸收的氣體的電子式____________;
(3)向溶液 A 中通入H2S 氣體, 有淡黃色沉淀產生, 寫出反應的離子方程式________ (不考慮空氣的影響)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A是一種裝飾品的主要成分,是地殼中含量最高的兩種元素形成的化合物。根據下圖轉化關系,回答下列問題。

(1)A的用途:________(任寫一種),B是________,D是________。
(2)寫出下列反應的化學方程式:①______________。
(3)寫出下列反應的離子方程式:②____________,③_______,⑤____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2SO2(g)+O2(g)![]() 2SO3(g)反應過程中的能量變化如圖所示(圖中E1表示無催化劑時正反應的活化能,E2表示無催化劑時逆反應的活化能)。下列有關敘述不正確的是
2SO3(g)反應過程中的能量變化如圖所示(圖中E1表示無催化劑時正反應的活化能,E2表示無催化劑時逆反應的活化能)。下列有關敘述不正確的是

A. 該反應的逆反應為吸熱反應,升高溫度可提高活化分子的百分數
B. 500℃、101kPa下,將1molSO2(g)和0.5molO2(g)置于密閉容器中充分反應生成SO3(g)放熱akJ,其熱化學方程式為2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 該反應中,反應物的總鍵能小于生成物的總鍵能
D. ΔH=E1-E2,使用催化劑改變活化能,但不改變反應熱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】KIO3可采用電解法制備,裝置如圖所示。下列敘述正確的是

A. 通電后陰極的電極反應式2H2O+2e-=2OH-+H2↑
B. 電解過程中通過陽離子交換膜的離子主要為K+,其遷移方向是從右到左
C. 電解過程中陽極附近pH增大
D. 當電路中通過1mol電子的電量時,會有0.5mol的KIO3生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水合肼(N2H4·H2O)是無色、有強還原性的液體,實驗室制各水合肼的原理為:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl 據此,某學生設計了下列實驗。
步驟1:制備NaC1O溶液。已知:3NaC1O![]() NaC1+NaC1O3
NaC1+NaC1O3

(1)用燒堿固體配制30%NaOH溶液時,所需玻璃儀器除量筒外還有_______(填字母)。
A.容量瓶 B.燒杯 C.移液管 D.玻璃棒
(2)裝置A中發生反應的離子方程式是__________;若裝置C中出現堵塞,玻璃管a中的現象為_______________;B中用冰水浴控制溫度在30℃以下,其主要目的是______________。
步驟2:制取水合肼。
控制反應溫度,將分液漏斗中的溶液緩慢滴入三頸燒瓶中,充分反應。加熱蒸餾三頸燒瓶內的溶液,收集108~114℃餾分。(已知:N2H4·H2O+2NaC1O=N2↑+3H2O+2NaC1)。
(3)分液漏斗中的溶液是___________(填“A”或“B”);
A.NaOH和NaC1O混合溶液 B.CO(NH2)2溶液

步驟3:肼的性質分析與測定。
(4)水合肼與氨水性質相似,屬于二元弱堿。水合肼與鹽酸反應產生的正鹽化學式為_______________。
(5)水合肼具有還原性,被氧化生成氮氣。稱取餾分0.3000g,加水配成加20.00mL溶液,一定條件下用0.1500 mol/L的I2溶液滴定。
①水合肼與碘溶液反應的化學方程式為_______________________________________;
②實驗測得消耗I2溶液的平均值為20.00mL,餾分中N2H4·H2O的質量分數為__________。(保留三位有效數字)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將4 mol A氣體和2mol B氣體在2 L的密閉容器中混合,并在一定條件下發生如下反應:2A(g)+B(g)![]() 2C(g),反應2 s后測得C的物質的量為1.2mol。下列說法不正確的是
2C(g),反應2 s后測得C的物質的量為1.2mol。下列說法不正確的是
A.用物質B表示2s內的平均反應速率為0.15 mol/(L·s)
B.用物質A表示2 s內的平均反應速率為0.3 mol/(L·s)
C.2 s后物質B的濃度為0.35 mol/L
D.2 s后物質A的轉化率為30%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關從海帶中提取碘的實驗原理和裝置能達到實驗目的的是

A. 用裝置甲灼燒碎海帶
B. 用裝置乙過濾海帶灰的浸泡液
C. 用裝置丙制備用于氧化浸泡液中I的Cl2
D. 用裝置丁吸收氧化浸泡液中I后的Cl2尾氣
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com