
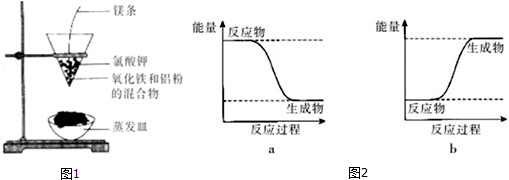
分析 (1)根據常見的放熱反應有:所有的物質燃燒、所有金屬與酸反應、金屬與水反應、所有中和反應、絕大多數化合反應和鋁熱反應;
常見的吸熱反應有:絕大數分解反應,個別的化合反應(如C和CO2)、少數置換反應(如C和H2O)、某些復分解(如銨鹽和強堿)和碳、一氧化碳、氫氣等還原金屬氧化物.
(2)反應劇烈,火星四射,漏斗下方有紅熱熔融物流出,說明該反應為放熱反應,反應物總能量大于生成物總能量.
解答 解:(1)a.燃燒CO放出熱量,屬于放熱反應,故a不選;
b.Ba(OH)2•8H2O晶體和NH4Cl晶體反應是銨鹽與堿反應,屬于吸熱反應,故b選;
c.鋁和稀鹽酸反應放出熱量,屬于放熱反應,故c不選;
d.NaOH溶液和稀鹽酸反應是酸堿中和反應,屬于放熱反應,故d不選;
故選b;
(2)反應劇烈,火星四射,漏斗下方有紅熱熔融物流出,說明該反應為放熱反應,方程式為:Fe2O3+2Al $\frac{\underline{\;高溫\;}}{\;}$Al2O3+2 Fe,反應物總能量大于生成物總能量,所以可用圖2中的a表示;
故答案為:放熱;Fe2O3+2Al $\frac{\underline{\;高溫\;}}{\;}$Al2O3+2 Fe;a.
點評 本題考查化學反應的熱量變化,學生應注重歸納中學化學中常見的吸熱或放熱的反應,對于特殊過程中的熱量變化的要熟練記憶來解答此類習題.


科目:高中化學 來源: 題型:選擇題
| A. | 含1mol溶質的任何溶液,物質的量濃度一定相等 | |
| B. | 體積相同,物質的量濃度相同的同種溶液所含溶質的粒子數一定相同 | |
| C. | 1L0.5mol•L-1CaCl2溶液中,Ca2+與Cl-的物質的量濃度都是0.5mol•L-1 | |
| D. | 從1L0.2mol•LNaOH溶液中取出100ml,這100ml溶液的物質的量濃度是0.02mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ③④ | C. | ①⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應的焓變為負值 | |
| B. | 化學方程式為 NO2(g)+CO(g)?CO2(g)+NO(g) | |
| C. | 降溫,正反應速率減小 | |
| D. | 恒溫時,增大壓強顏色加深,平衡逆向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C與Si位于同一主族,且干冰與SiO2都是酸性氧化物,所以二者晶體類型相同 | |
| B. | NaCl和AlCl3均為強電解質,二者在熔融狀態下都能導電 | |
| C. | 從晶體類型上來看物質的熔沸點,其規律是:原子晶體>離子晶體>分子晶體 | |
| D. | 第二周期非金屬元素的氣態氫化物溶于水后,水溶液均為酸性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ | |
| B. | NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | |
| C. | 2Fe+3Cl2$\frac{\underline{\;點燃\;}}{\;}$2FeCl3 | |
| D. | Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com