
| A. | ②③④⑤ | B. | ①③⑤ | C. | ②④ | D. | ③ |
分析 ①根據離子半徑的判斷標準,核外電子層數多的大于核外電子層數少的,當核外電子層數相同時,核內質子數大的離子半徑小;
②氧化還原反應中一定有電子的轉移和化合價的升降;
③強堿和弱堿在水溶液中都為堿性;
④與鹽酸反應生成氯化鈉、氯化銨、氨氣或氯化鈉、氫氣;
⑤氮化鈉和氫化鈣中陽離子為Na+,Ca2+,陰離子為H-,N3-,陰陽離子電子層結構不同;
解答 解:①中鈉離子和氮離子核外均有十個電子,鈉離子的核內質子數大于氮的核內質子數,故離子半徑氮離子大于鈉離子,氫離子核外沒有電子,故離子半徑為氮離子>鈉離子>氫離子,故①錯誤;
②在第一個反應中,是復分解反應,第二個反應有化合價的升降,為氧化還原反應,故②錯誤;
③第一個反應有氫氧化鈉和氨氣生成,故溶液顯堿性,第二個反應有氫氧化鈉生成,故溶液顯堿性,故③正確;
④第一個反應產物與鹽酸反應生成氯化鈉和氯化銨兩種物質,故④錯誤;
⑤氮化鈉和氫化鈣的陽離子電子結構不相同,陰離子結構也不相同,故⑤錯誤;
故選D.
點評 本題考查了離子半徑的判斷標準,氧化還原反應的本質等知識點,掌握基礎是關鍵,題目較簡單.


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:選擇題
| A. | 熔點:庚烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 含氫量:甲烷>乙烯>乙炔>苯 | |
| C. | 密度:CCl4>CHCl3>苯>H2O | |
| D. | 同物質的量物質燃燒耗O2量:已烷>環已烷>苯>苯甲酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
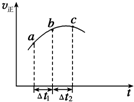 向絕熱恒容密閉容器中通入SO2和NO2一定條件下使反應SO2(g)+NO2(g)?SO3(g)+NO(g)達到平衡,正反應速率隨時間變化的示意圖如圖所示,由圖可得出的正確結論是( )
向絕熱恒容密閉容器中通入SO2和NO2一定條件下使反應SO2(g)+NO2(g)?SO3(g)+NO(g)達到平衡,正反應速率隨時間變化的示意圖如圖所示,由圖可得出的正確結論是( )| A. | △t1=△t2時,SO2的轉化率:a~b段小于b~c段 | |
| B. | 反應物的總能量低于生成物的總能量 | |
| C. | 反應物濃度:a點小于b點 | |
| D. | 反應在C點達到平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素編號 | 元素性質或原子結構 |
| T | M層上有2對成對電子 |
| X | 最外層電子數是次外層電子數的2倍 |
| Y | 常溫下單質為雙原子分子,其氫化物水溶液呈堿性 |
| Z | 元素最高正價是+7價 |
 (用元素符號表示).
(用元素符號表示).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A~J分別表示中學化學中常見的一種物質,它們之間相互關系如圖所示(部分反應物、生成物沒有列出),且已知G為主族元素的固態氧化物,A、B、C、D、E、F六種物質中均含同一種元素.請填寫下列空白:
A~J分別表示中學化學中常見的一種物質,它們之間相互關系如圖所示(部分反應物、生成物沒有列出),且已知G為主族元素的固態氧化物,A、B、C、D、E、F六種物質中均含同一種元素.請填寫下列空白: NH3•H2O+H+.
NH3•H2O+H+.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 液態氟化氫中存在氫鍵,所以其分子比氯化氫更穩定 | |
| B. | 由碳、氮原子形成的化合物比金剛石硬,其主要原因是碳氮鍵比碳碳鍵更短 | |
| C. | S8和NO2都是共價化合物,NH4Cl和CaC2都是離子化合物 | |
| D. | 若ⅡA某元素的原子序數為m,則同周期ⅢA元素的原子序數有可能為m+10 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
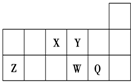
| A. | 元素X與元素Z的最高正化合價之和的數值等于8 | |
| B. | 原子半徑的大小順序為:Y>Z | |
| C. | 離子Y2-和Z3+的核外電子總數和電子層數都不相同 | |
| D. | 元素W的單質比Q的熔點低 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com