
【題目】將足量的CO2不斷通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀與通入CO2的量的關系可表示為( )
A. 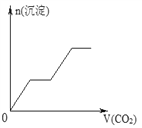 B.
B. 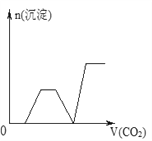
C. 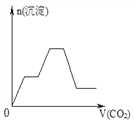 D.
D. 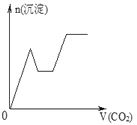
【答案】C
【解析】試題分析:通入CO2,立刻就有沉淀BaCO3產生:CO2+Ba(OH)2=BaCO3↓+H2O,將Ba(OH)2消耗完后,接下來消耗NaOH:CO2+2NaOH=Na2CO3+H2O,因而此段不會產生沉淀(即沉淀的量保持不變),NaOH被消耗完后,接下來二氧化碳又與NaAlO2反應產生沉淀,沉淀的量繼續增加,CO2+3H2O+2NaAlO2=2Al(OH)3↓+Na2CO3,當NaAlO2消耗完時產生最大量的沉淀,繼續通入CO2,與上面反應的產物Na2CO3反應生成碳酸氫鋇,然后與BaCO3反應生成碳酸氫鋇,此時沉淀開始溶解,最后剩余沉淀為Al(OH)3,反應的離子方程式分別是CO2+H2O+Na2CO3=2NaHCO3、BaCO3+CO2+H2O=Ba(HCO3)2,答案選C。


科目:高中化學 來源: 題型:
【題目】鐵鉀礬[KxFey(SO4)m·nH2O]常用作工業媒染劑。其組成可用如下方法測定:
①準確稱取2.0120g樣品配成100mL溶液A。
②準確量取25.00mL溶液A,加入鹽酸酸化的BaCl2溶液至沉淀完全,過濾、洗滌、干燥至恒重,得到白色固體0.466g。
③準確量取25.00mL溶液A,加入足量的KI溶液,以淀粉為指示劑,用0.1250 mol·L-1的Na2S2O3溶液滴定,消耗8.00mL至終點(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
(1)要檢驗出A溶液中存在的Fe3+,可以加入 溶液。
(2)已知室溫下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-5 molL-1,應保持溶液中c(Ba2+)≥ mol·L-1。
(3)步驟③中判斷滴定終點的方法是 。
(4)通過計算確定鐵鉀礬的組成(寫出計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A. 摩爾是國際科學界建議采用的一種物理量
B. 摩爾是物質的量的單位,簡稱摩,符號為mol
C. 摩爾可以把物質的宏觀數量與微觀粒子的數量聯系起來
D. 氫氧化鈉的摩爾質量是40
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組通過實驗研究Na2O2與水的反應。
操作 | 現象 |
向盛有4.0g Na2O2的燒杯中加入50mL蒸餾水 | 劇烈反應,產生能使帶火星木條復燃的氣體,得到的無色溶液a |
向溶液a中滴入兩滴酚酞 | ⅰ.溶液變紅 ⅱ.10分鐘后溶液顏色明顯變淺,稍后,溶液變為無色 |
(1)Na2O2的電子式為___________。它與水反應的離子方程式是__________________。
(2)甲同學認為ⅱ中溶液褪色是溶液a中存在較多的H2O2,H2O2與酚酞發生了反應,并實驗證實了H2O2的存在;取少量溶液a,加入試劑___________(填化學式),有氣體產生。
(3)乙同學查閱資料獲悉:用KMnO4可以氧化H2O2并測定其含量。取20.00mL溶液,用稀H2SO4酸化,用0.002mol/L KMnO4溶液滴定,產生氣體,溶液褪色,至終點時共消耗10.00mL KMnO4溶液。
①實驗中,滴定時KMnO4溶液應裝在__________(酸或堿)式滴定管中。
②用單線橋標出該反應電子轉移的方向和數目:_______________。
2MnO4-+5H2O2+6H+ = 2Mn2++5O2↑+8H2O。
③溶液a中 c(H2O2)=___________ mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是部分短周期元素的單質及其化合物(或其溶液)的轉化關系,已知B、C、D、E是非金單質,且在常溫常壓下都是氣體;化合物G的焰色反應為黃色,化合物I和J通常狀況下呈氣態;反應①是化工生產中的一種重要固氮反應 
請回答下列問題:
(1)分別寫出E、F的電子式:E , F;
(2)實驗室制J的化學方程式 .
(3)由F制取B的反應中,每產生標準狀況下11.2L的B,轉移電子的物質的量為;
(4)在C、D、E.、I、J分子中,以極性鍵結合的是(填相應的字母,下同),以非極性鍵結合的是;
(5)用電子式表示I的形成過程;
(6)現將標準狀況下1.12L二氧化碳通入60mL 1mol/L的A的最高價氧化物對應的水化物溶液中,則反應后溶液中溶質的物質的量之比為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂及其化合物一般無毒(或低毒)、無污染,鎂電池放電時電壓高且平穩,因此鎂電池越來越成為人們研制綠色電池的焦點。其中一種鎂電池的反應:為:xMg+Mo3S4![]() MgxMo3S4;在鎂原電池放電時,下列說法錯誤的是( )
MgxMo3S4;在鎂原電池放電時,下列說法錯誤的是( )
A. Mg2+向正極遷移 B. 正極反應為:Mo3S4+2xe-═Mo3S42x-
C. Mo3S4發生氧化反應 D. 負極反應為:xMg-2xe-═xMg2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】世界能源消費的90%以上依靠化學技術。
(1)工業制氫的一個重要反應是利用CO還原H2O(g)。
已知:C(石墨,s)+O2(g)═CO2(g) △H=-394k J/mol
2C(石墨,s)+O2(g)═2CO(g) △H=-222k J/mol
H2(g)+1/2O2(g)═H2O(g) △H=-242k J/mol
則CO還原H2O(g)的熱化學方程式為_________________________。
(2)氫能被視為最具發展潛力的綠色能源,寫出堿式氫氧燃料電池的工作時的負極電極反應:_______。
(3)一種新型鋰離子二次電池——磷酸鐵鋰(LiFePO4)電池。作為正極材料的磷酸鐵鋰在充、放電時的局部放大示意圖如下圖,寫出該電池充電時的陽極電極反應__________。

(4)LiOH是制備鋰離子電池正極材料的重要原料,其電解法制備裝置如上圖。氣體a通入淀粉KI溶液中,發現溶液變藍,持續一段時間后,藍色逐漸褪去。則M極為電源的________(填“正”或“負”)極,B極區電解液為_______溶液(填化學式),該離子交換膜是________(填“陽”或“陰”)離子交換膜。
(5)上圖所示裝置(陰、陽極均為惰性電極)可用于電解尿素(CONH2)2)的堿性溶液制取氫氣。該裝置中陽極的電極反應式為___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D四種元素,它們原子的核電荷數均小于18,且依次遞增,A原子核內僅有一個質 子;B原子的電子總數與D原子的最外層電子數相等;A原子與B原子的最外層電子數之和與C原子的最外層電子數相等;D原子有兩個電子層,最外層電子數是次外層電子數的3倍.
(1)試推斷它們各是什么元素,寫出它們的元素符號:A , B , C , D .
(2)畫出D的離子結構示意圖 .
(3)由這四種元素組成的三核10電子的分子為 , 四核10電子的分子是 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com