
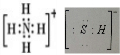 ,寫出再生反應的化學方程式:2NH4HS+O2$\frac{\underline{\;一定條件\;}}{\;}$2NH3•H2O+2S;NH3的沸點高于H2S,是因為NH3分子之間存在著一種叫分子間作用的作用力.
,寫出再生反應的化學方程式:2NH4HS+O2$\frac{\underline{\;一定條件\;}}{\;}$2NH3•H2O+2S;NH3的沸點高于H2S,是因為NH3分子之間存在著一種叫分子間作用的作用力.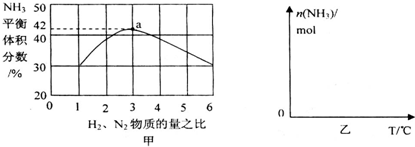
分析 (1)NH4HS的電子式是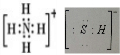 ;H2S雜質常用氨水吸收,產物為NH4HS,一定條件下向NH4HS溶液中通入空氣,得到單質硫并使吸收液再生,反應過程中生成一水合氨,依據原子守恒和電子守恒配平書寫化學方程式;NH3分子間存在氫鍵,所以NH3的沸點高于H2S;
;H2S雜質常用氨水吸收,產物為NH4HS,一定條件下向NH4HS溶液中通入空氣,得到單質硫并使吸收液再生,反應過程中生成一水合氨,依據原子守恒和電子守恒配平書寫化學方程式;NH3分子間存在氫鍵,所以NH3的沸點高于H2S;
(2)硫酸氫銨中的硫氫根離子第二步電離程度Ki2=1.2×10-2,非常的大,所以硫酸氫銨溶液的酸性強同濃度的氯化銨;
(3)依據反應特征N2+3H2=2NH3,反應前后氣體體積減小為生成氨氣的體積,相同條件下,氣體體積比等于氣體物質的量之比,圖象分析可知平衡狀態氨氣體積含量42%,設平衡混合氣體體積為 100,氨氣為體積42,計算反應的氮氣,依據氣體體積比計算原混合氣體中氮氣體積,得到平衡狀態下氮氣體積分數;
(4)合成氨的反應是放熱反應,開始反應,氨氣物質的量增大,達到平衡狀態,繼續升溫,平衡逆向進行,氨氣物質的量減小,據此畫出變化圖象;
(5)依據反應是氣體體積減小的放熱反應,結合平衡移動原理分析判斷.
解答 解:(1)NH4HS的電子式是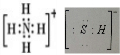 ;H2S雜質常用氨水吸收,產物為NH4HS,一定條件下向NH4HS溶液中通入空氣,得到單質硫并使吸收液再生,反應過程中生成一水合氨,依據原子守恒和電子守恒配平書寫化學方程式為:2NH4HS+O2$\frac{\underline{\;一定條件\;}}{\;}$2NH3•H2O+2S;
;H2S雜質常用氨水吸收,產物為NH4HS,一定條件下向NH4HS溶液中通入空氣,得到單質硫并使吸收液再生,反應過程中生成一水合氨,依據原子守恒和電子守恒配平書寫化學方程式為:2NH4HS+O2$\frac{\underline{\;一定條件\;}}{\;}$2NH3•H2O+2S;
;NH3分子間存在氫鍵,所以NH3的沸點高于H2S,
故答案為: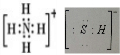 ;2NH4HS+O2$\frac{\underline{\;一定條件\;}}{\;}$2NH3•H2O+2S;分子間作用;
;2NH4HS+O2$\frac{\underline{\;一定條件\;}}{\;}$2NH3•H2O+2S;分子間作用;
(2)硫酸氫銨中的硫氫根離子第二步電離程度Ki2=1.2×10-2,非常的大,而氯化銨是水解呈酸性,所以硫酸氫銨溶液的酸性強同濃度的氯化銨,
故答案為:硫酸氫銨;硫酸氫銨中的硫氫根離子第二步電離程度Ki2=1.2×10-2,非常的大,大于銨根離子水解產生的酸性;
(3)依據反應特征N2+3H2=2NH3 △V
1 3 2 2
平衡體積 V V
即反應前后氣體體積減小為生成氨氣的體積,相同條件下,氣體體積比等于氣體物質的量之比,圖象分析可知平衡狀態氨氣體積含量42%,設平衡混合氣體體積為100,氨氣為體積42,則反應前氣體體積100+42=142,氮氣和氫氣按照1:3混合,氮氣體積=142×$\frac{1}{4}$=35.5,依據化學方程式計算反應的氮氣體積為21,平衡狀態氮氣為35.5-21=14.5,則氮氣體積分數為14.5%;
故答案為:14.5%;
(4)合成氨的反應是放熱反應,開始反應,氨氣物質的量增大,達到平衡狀態,繼續升溫,平衡逆向進行,氨氣物質的量減小,畫出的圖象為: ,故答案為:
,故答案為: ;
;
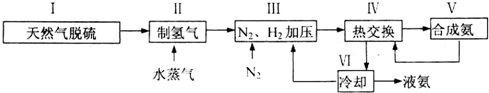
(5)分析流程合成氨放熱通過Ⅳ熱交換器加熱反應混合氣體,使反應達到所需溫度,提高合成氨原料總轉化率,依據平衡移動原理分析,分離出氨氣促進平衡正向進行,把平衡混合氣體中氮氣和氫氣重新循環使用,提高原理利用率;
故答案為:Ⅳ;分離液氨,未反應的氮氣和氫氣循環使用.
點評 本題考查了化學平衡影響因素分析,平衡計算應用,注意反應特征的計算應用,圖象繪制,掌握基礎是關鍵,題目難度較大.


 星級口算天天練系列答案
星級口算天天練系列答案 芒果教輔達標測試卷系列答案
芒果教輔達標測試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 0.9gH2O中含有電子數為NA | |
| B. | 11.2 LCl2中含有的原子數為NA | |
| C. | 常溫常壓下,48gO2和O3含有的氧原子數均為3NA | |
| D. | 標準狀況下,11.2L CCl4所含的分子數為0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  反應過程中能量關系可用圖表示 | |
| B. | 該反應為自發反應 | |
| C. | 若將該反應設計成原電池則鋅為負極 | |
| D. | 若將其設計為原電池,當有32.5g鋅溶解時,正極放出氣體為11.2L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4Cl溶液,NaOH溶液 | B. | 濃NaOH溶液,NH4Cl晶體,濃H2SO4 | ||
| C. | 濃氨水,濃硫酸 | D. | NH4Cl固體,消石灰,堿石灰 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 56g氮氣所含有的原子數目為NA | |
| B. | 標準狀況下,22.4L苯中含有NA個水分子化學反應中 | |
| C. | 0.5mol金屬鎂變成鎂離子時失去電子的數目為NA | |
| D. | 標準狀況下,22.4L氦氣所含的原子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:As>C1>P | B. | 熱穩定性:HC1>AsH3>HBr | ||
| C. | 還原性:As3->S2->C1- | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com