
【題目】氯氣是一種重要的化學物質,在生產和生活中有廣泛的用途。
(1)實驗室除了可用二氧化錳和濃鹽酸反應制取氯氣外,還可以用其他很多方法制取氯氣,其中用氯酸鉀和濃鹽酸反應制備氯氣的化學方程式可表示為:KClO3+6HCl(濃)=KCl+3Cl2↑+3H2O,其中該反應的氧化劑為_____________(填化學式,下同),還原劑為_________________,若反應產生0.3mol Cl2,則消耗的還原劑的物質的量為________mol,反應轉移的電子數是_______________。
(2)已知:在加熱條件下,3NaClO![]() 2NaCl+NaClO3.則在加熱條件下,向NaOH溶液中通少量氯氣時的反應方程式可表示為___________________(用一個總反應方程式表示,假設每步反應均充分進行);某溫度下,將氯氣通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,經測定,NaClO、NaClO3的物質的量之比為4:1,則反應中被氧化的氯元素與被還原的氯元素的物質的量之比為_________________。
2NaCl+NaClO3.則在加熱條件下,向NaOH溶液中通少量氯氣時的反應方程式可表示為___________________(用一個總反應方程式表示,假設每步反應均充分進行);某溫度下,將氯氣通入NaOH溶液中,得到NaCl、NaClO、NaClO3的混合液,經測定,NaClO、NaClO3的物質的量之比為4:1,則反應中被氧化的氯元素與被還原的氯元素的物質的量之比為_________________。
【答案】KClO3 HCl 0.5 3.01×1023個(0.5 NA個) 3Cl2+6NaOH![]() NaClO3 +5NaCl+3H2O 5:9
NaClO3 +5NaCl+3H2O 5:9
【解析】
(1)根據反應KClO3+6HCl(濃)=KCl+3Cl2↑+3H2O可以看出,該氧化還原反應中,若有3 mol氯氣生成,則有1 mol KClO3中Cl元素化合價降低為0價,作氧化劑;6 mol HCl中有5 mol氯元素化合價升高為0價,1 mol HCl起酸性作用生成KCl,即作還原劑的濃鹽酸為5 mol,再結合氯氣和轉移電子之間的關系式、原子守恒計算還原劑的物質的量與實際轉移電子數;
(2)加熱下,氯氣和濃氫氧化鈉溶液反應生成氯化鈉、氯酸鈉和水;Cl2生成ClO-與ClO3-是被氧化的過程,Cl2生成NaCl是被還原的過程,氧化還原反應中氧化劑和還原劑之間得失電子數目相等,根據ClO-與ClO3-的物質的量濃度之比可計算失去電子的總物質的量,進而可計算得到電子的總物質的量,可計算被還原的氯元素的物質的量,則可計算被還原的氯元素和被氧化的氯元素的物質的量之比。
根據反應KClO3+6HCl(濃)=KCl+3Cl2↑+3H2O可以看出,該氧化還原反應中,若有3 mol Cl2生成,則有1 mol KClO3中Cl元素化合價降低為0價,6 mol HCl中有5 mol氯元素化合價升高為0價,1 mol HCl起酸性作用生成KCl,即作還原劑的濃鹽酸為5 mol。化合價降低值=化合價升高值=轉移電子數=5 mol。則產生0.3 mol Cl2,則消耗的還原劑的物質的量是0.5 mol,轉移電子的物質的量也為0.5 mol,所以轉移電子數為0.5 mol![]() 6.02
6.02![]() 1023mol-1 = 3.01×1023個(0.5 NA),
1023mol-1 = 3.01×1023個(0.5 NA),
故答案為:KClO3+6HCl(濃)=KCl+3Cl2↑+3H2O;0.5 mol;3.01×1023個(0.5 NA個);
(2)常溫下,Cl2可與NaOH溶液反應生成NaCl、NaClO和水,其化學方程式為:Cl2+NaOH=NaCl+NaClO+H2O,根據題意可知,在加熱條件下,3NaClO![]() 2NaCl+NaClO3,結合上述兩式可得,則在加熱條件下,向NaOH溶液中通少量氯氣時的反應方程式可表示為3Cl2+6NaOH
2NaCl+NaClO3,結合上述兩式可得,則在加熱條件下,向NaOH溶液中通少量氯氣時的反應方程式可表示為3Cl2+6NaOH![]() NaClO3 +5NaCl+3H2O;
NaClO3 +5NaCl+3H2O;
Cl2生成ClO與ClO3是被氧化的過程,化合價分別由0價升高為+1價和+5價,ClO與ClO3的物質的量濃度之比為4:1,則可設ClO為4 mol,ClO3為1 mol,被氧化的Cl共為5 mol,失去電子的總物質的量為4mol×(10)+1mol×(50) = 9mol,氧化還原反應中氧化劑和還原劑之間得失電子數目相等,Cl2生成NaCl是被還原的過程,化合價由0價降低為1價,則得到電子的物質的量也應為9 mol,則被還原的Cl的物質的量為9 mol,所以被氧化的氯元素的物質的量和被還原的氯元素之比為5 mol:9 mol =5:9,
故答案為:3Cl2+6NaOH![]() NaClO3 +5NaCl+3H2O;5:9。
NaClO3 +5NaCl+3H2O;5:9。


 舉一反三期末百分沖刺卷系列答案
舉一反三期末百分沖刺卷系列答案科目:高中化學 來源: 題型:
【題目】有關如下所示化合物的說法不正確的是( )

A. 既可以與Br2的CCl4溶液發生加成反應,又可以在光照下與Br2發生取代反應
B. 1mol該化合物最多可以與3molNaOH反應
C. 既可以催化加氫,又可以使酸性KMnO4溶液褪色
D. 既可以與FeCl3溶液發生顯色反應,又可以與NaHCO3溶液反應放出CO2氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖甲是一種利用微生物將廢水中的尿素(H2NCONH2)直接轉化為對環境友好物質的原電池裝置。現利用甲裝置產生的電能對乙裝置中的飽和食鹽水進行電解(A、B皆為石墨電極)。下列說法中不正確的是( )

①M電極反應式:H2NCONH2+H2O+6e-=CO2↑+N2↑+6H+
②當A電極產生11.2mL氣體(標況)時,則N電極消耗25×10-4mol氣體
③甲中H+透過質子交換膜由右向左移動
④A電極應與X相連接
⑤反應一段時間后,乙裝置U型管中的溶液pH變大
A. ①③ B. ①③⑤ C. ①②③ D. ②④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(題文)(題文)一定溫度下,在三個容積相同的恒容密閉容器中按不同方式投入反應物,發生反應2SO2(g)+ O2(g)![]() 2SO3(g)(正反應放熱),測得反應的相關數據如下:
2SO3(g)(正反應放熱),測得反應的相關數據如下:
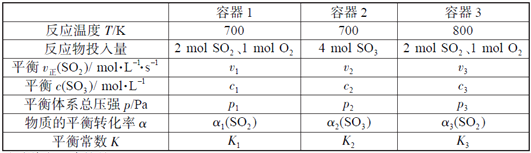
下列說法正確的是
A. v1< v2,c2< 2c1 B. K1> K3,p2> 2p3
C. v1< v3,α1(SO2 ) >α3(SO2 ) D. c2> 2c3,α2(SO3 )+α3(SO2 )<1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿式硫酸鋁溶液可用于煙氣脫硫。室溫下向一定濃度的硫酸鋁溶液中加入一定量的碳酸鈣粉末,反應后經過濾得到堿式硫酸鋁溶液,反應方程式為
(2x)Al2(SO4)3+3xCaCO3+3xH2O![]() 2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1x)Al2(SO4)3·xAl(OH)3中x值的大小影響堿式硫酸鋁溶液的脫硫效率。
(1)制備堿式硫酸鋁溶液時,維持反應溫度和反應時間不變,提高x值的方法有___________________。
(2)堿式硫酸鋁溶液吸收SO2過程中,溶液的pH___________(填“增大”、“減小”、“不變”)。
(3)通過測定堿式硫酸鋁溶液中相關離子的濃度確定x的值,測定方法如下:
①取堿式硫酸鋁溶液25.00 mL,加入鹽酸酸化的過量BaCl2溶液充分反應,靜置后過濾、洗滌,干燥至恒重,得固體2.3300 g。
②取堿式硫酸鋁溶液2.50 mL,稀釋至25 mL,加入0.1000 mol·L1EDTA標準溶液25.00 mL,調節溶液pH約為4.2,煮沸,冷卻后用0.08000 mol·L1CuSO4標準溶液滴定過量的EDTA至終點,消耗CuSO4標準溶液20.00 mL(已知Al3+、Cu2+與EDTA反應的化學計量比均為1∶1)。
計算(1x)Al2(SO4)3·xAl(OH)3中的x值(寫出計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗裝置不能達到實驗目的的是
A | B | C | D |
|
|
|
|
實驗室制取蒸餾水 | 用SO2和NaOH溶液做噴泉實驗 | 證明Na2CO3的熱穩定性比NaHCO3好 | 證明銅與濃硝酸的反應是放熱反應 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在空氣中加熱5.49g草酸鈷晶體(CoC2O4·2H2O,摩爾質量為183g/mol),受熱過程中不同溫度范國內分別得到一種固體物質,其質量如下表:
溫度范圍℃ | 固體質量/g |
150~210 | 4.41 |
290~320 | 2.41 |
經測定,210℃~290℃過程中產生的氣體只有CO2,則290℃~320℃溫度范圍內的固體物質是
A. CoO B. Co2O3 C. Co3O4 D. Co4O5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A為常見的金屬單質,根據下圖所示的關系:
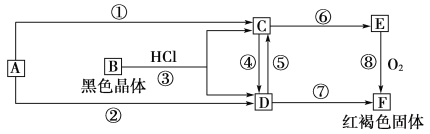
(1)確定A、B、C、D、E、F的化學式,A為________,B為________,C為________,D為________,E為________,F為________。
(2)寫出①⑧的化學方程式,④、⑤的離子方程式。
①_________________________________________________,
⑧_________________________________________________,
④________________________________________________,
⑤___________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:D為烴;E分子中碳元素與氫元素的質量之比6∶1,相對分子質量為44,其燃燒產物只有CO2和H2O。A的最簡式與F相同,且能發生銀鏡反應,可由淀粉水解得到。

(1)A的結構簡式為__________________。
(2)寫出D→E的化學方程式:_______________________。
(3)下列說法正確的是____。
A.有機物F能使石蕊溶液變紅
B.用新制的氫氧化銅無法區分有機物C、E、F的水溶液
C.等物質的量的C和D分別完全燃燒消耗氧氣的量相等
D.可用飽和碳酸鈉溶液除去有機物B中混有的少量C、F
E. B的同分異構體中能發生銀鏡反應的酯類共有2種
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com