
【題目】(1)在標準狀況下①3.36LNH3②1.204×1023個CH4③18gH2O④0.4molHCl。
a.體積由大到小的順序_____(填序號,下同)。
b.氫原子個數由大到小的順序___。
(2)18.6gNa2X含有0.6molNa+,則X2-的摩爾質量為__。
(3)若ag某氣體中含有的分子數為b,則cg該氣體在標況下體積是(設NA為阿伏加德羅常數的值)____L。
【答案】④>②>①>③ ③>②>①>④ 16g/mol ![]()
【解析】
根據n=N/NA=m/M=V/Vm進行計算,V為標準狀況下的氣體體積。
(1)在標準狀況下①、②、④為氣體,③為液體,①3.36LNH3,物質的量為0.15mol,②1.204×1023個CH4的體積為1.204×1023/NA=0.2mol,為4.48L,④0.4molHCl,體積為8.96L,則體積由大到小的順序為④>②>①>③;①3.36LNH3,物質的量為0.15mol,含有氫原子數目=n(NH3)![]() 3=0.45NA,②1.204×1023個CH4的體積為1.204×1023/NA=0.2mol,含有氫原子數目=n(CH4)
3=0.45NA,②1.204×1023個CH4的體積為1.204×1023/NA=0.2mol,含有氫原子數目=n(CH4)![]() =0.8NA,③18gH2O為1mol,含有氫原子數目=n(H2O)
=0.8NA,③18gH2O為1mol,含有氫原子數目=n(H2O)![]() 2=2NA,④0.4molHCl,含有氫原子數目=n(HCl)
2=2NA,④0.4molHCl,含有氫原子數目=n(HCl)![]() 1=0.4NA,氫原子個數由大到小的順序為③>②>①>④;
1=0.4NA,氫原子個數由大到小的順序為③>②>①>④;
(2)0.6molNa+的質量為13.8g,則X的質量為4.8g,已知N(Na+):N(X2-)=2:1,則n(X2-)=0.3mol,M=m/n=4.8g/0.3mol=16g/mol;
(3)cg該氣體的分子個數=cg![]() b/ag,則物質的量=c
b/ag,則物質的量=c![]() b/(a
b/(a![]() NA),標況下的體積=c
NA),標況下的體積=c![]() b
b![]() 22.4/(a
22.4/(a![]() NA)L。
NA)L。


科目:高中化學 來源: 題型:
【題目】在密閉容器中發生下列反應 aA(g) ![]() cC(g)+dD(g),反應達到平衡后,將氣體體積壓縮到原來的一半,當再次達到平衡時,D的濃度為原平衡的1.7倍,下列敘述正確的是( )
cC(g)+dD(g),反應達到平衡后,將氣體體積壓縮到原來的一半,當再次達到平衡時,D的濃度為原平衡的1.7倍,下列敘述正確的是( )
A. A的轉化率變小 B. 平衡向正反應方向移動
C. D的物質的量變多 D. 再次平衡時的逆反應速率小于原平衡的正反應速率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】區別植物油和礦物油的正確方法是( )
A.加酸性高錳酸鉀溶液,振蕩
B.加NaOH溶液,煮沸
C.加新制Cu(OH)2懸濁液,煮沸
D.加溴水,振蕩
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據元素周期表和元素周期律,判斷下列敘述不正確的是

A. 氣態氫化物的穩定性:H2O>NH3>SiH4
B. 氫元素與其他元素可形成共價化合物或離子化合物
C. 上圖所示實驗可證明元素的非金屬性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118號元素在周期表中位于第七周期0族
”(ào)命名的第118號元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知2SO2(g)+O2(g)![]() 2SO3(g),△H=-198kJ/mol,在 V2O5存在時反應過程中的能量變化如圖所示。下列敘述正確的是
2SO3(g),△H=-198kJ/mol,在 V2O5存在時反應過程中的能量變化如圖所示。下列敘述正確的是
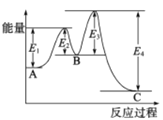
A. △H= E4- E3+E2-E1
B. 加入V2O5后反應經過兩步完成,其中第一步決定反應速率
C. 加入V2O5,△H不變,但反應速率改變
D. 向密閉容器中充入2molSO2和1molO2,發生上述反應達平衡時,反應放熱198kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于常溫下pH=12的稀氨水,下列敘述不正確的是
A. 溶液中c (OH-)=1.010-2 mol·L-1
B. 由水電離出的c (OH-)=1.010-12 mol·L-1
C. 加水稀釋后,氨水的電離程度增大
D. 加入少量NH4Cl固體,溶液pH變大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是無機物 A~J在一定條件下的轉化關系(部分產物及反應條件未列出)。其中C為紅棕色氣體;H和I是兩種常見的金屬單質;過量I與 D溶液反應生成A。
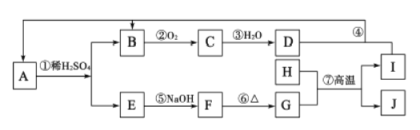
請填寫下列空白:
(1)H元素在周期表中的位置是________;寫出①的離子反應方程式:_________;檢驗E溶液中陽離子的最佳試劑為________。
(2)這類反應常用于冶煉高熔點的金屬。用MnO2冶煉金屬錳的反應中氧化劑與還原劑的物質的量之比為__________。
(3)SCR技術處理機動車尾氣時,在催化條件下利用氨氣與C反應,生成無污染的物質。發生反應的化學方程式為__________。
(4)F與NaClO、NaOH溶液反應,可制得一種“綠色”高效凈水劑K2FeO4。每生成1molFeO42-時轉移____________mol電子。
(5)B為大氣污染物,利用炭粉可以將其還原為無污染的物質X2。
已知:X2(g)+O2(g)=2XO(g) △H=+180.6kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
寫出用碳粉還原B的熱化學方程式__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機化合物的結構簡式如圖所示.有關該化合物的敘述不正確的是( )

A. 該有機物的分子式為C11H12O2
B. 1mol該物質最多能與4mol H2發生加成反應
C. 該有機物在一定條件下,可以發生取代、氧化、酯化反應
D. 該有機物能與熱的新制氫氧化銅懸濁液反應,生成磚紅色沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A. 鉛蓄電池在放電過程中,負極質量減小,正極質量增加
B. 常溫下,反應C(s)+CO2(g)===2CO(g)不能自發進行,則該反應的![]()
C. 應用蓋斯定律可計算某些難以直接測量的反應焓變
D. 1g碳與適量水蒸氣反應生成 CO和H2,吸收10.94kJ熱量,則熱化學方程式為:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ/mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com