
 |  | 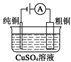 | 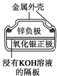 |
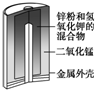
| 圖Ⅰ 堿性鋅錳電池 | 圖Ⅱ 鉛硫酸蓄電池 | 圖Ⅲ 電解精煉銅 | 圖Ⅳ 銀鋅紐扣電池 |
| A. | 圖Ⅰ所示電池中,MnO2的作用是催化劑 | |
| B. | 圖Ⅱ所示電池充電過程中,陽極的反應為:PbSO4+2H2O+2e-═PbO2+SO42-+4H+ | |
| C. | 圖Ⅲ所示裝置工作過程中,若陽極質量減少6.4 g,則電路中轉移電子數為0.2×6.02×1023 | |
| D. | 圖Ⅳ所示電池中,Ag2O是氧化劑,電池工作過程中還原為Ag |
分析 A.二氧化錳作正極;
B.電池充電過程中,陽極上硫酸鉛失電子生成二氧化鉛;
C粗銅中含有還原性強于銅的雜質鐵、鋅,電解過程中優先放電;
D.Zn失電子作負極,Ag2O得電子作正極.
解答 解:A.該電池反應中二氧化錳得到電子被還原,為原電池的正極,不是催化劑,故A錯誤;
B.電池充電過程中,陽極上硫酸鉛失電子生成二氧化鉛,其電極方程式為:PbSO4+2H2O-2e-═PbO2+SO42-+4H+,故B錯誤;
C.電解精煉銅時,陽極粗銅中含有活潑性較強的鐵、先等雜質,電解時鐵、鋅雜質先放電,且鐵摩爾質量小于銅的64g/mol,鋅的摩爾質量大于銅的摩爾質量,所以陽極減少6.4g,轉移的電子數不一定為0.2×6.02×1023,故C錯誤;
D.Zn失電子作負極,Ag2O得電子作正極,Ag2O作氧化劑被還原為Ag,故D正確;
故選D.
點評 本題考查原電池和電解池原理,側重于學生的分析能力的考查,明確電極上發生的反應是解本題關鍵,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 用干燥的潔凈玻璃棒蘸取溶液,滴在pH試紙上跟標準比色卡比較 | |
| B. | 將溶液倒在pH試紙上,跟標準比色卡比較 | |
| C. | 將pH試紙放入溶液中觀察其顏色變化,跟標準比色卡比較 | |
| D. | 試管內放少量溶液,煮沸,把pH試紙放在管口,觀察顏色,跟標準比色卡比較 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4句 | B. | 5句 | C. | 6句 | D. | 7句 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 利用太陽能等清潔能源代替化石燃料,有利于節約資源、保護環境 | |
| B. | 電池中的重金屬等污染土壤,可以回收再利用以減少污染、保護資源 | |
| C. | 人們日常生活中用到各種化學品,應盡量減少甚至不使用 | |
| D. | 城市機動車成為PM2.5(直徑≤2.5微米的顆粒物,也稱為可入肺顆粒物,有毒、有害)主要源頭,必須加以控制 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol•L-1 pH為9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| B. | 將標準狀況下的2.24LCO2通入150mL 1mol•L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-) | |
| C. | 0.1mol•L-1的醋酸pH=a,0.01mol•L-1的醋酸pH=b,則a+1>b | |
| D. | 常溫時①pH=12的氨水②pH=12的NaOH溶液,將兩溶液稀釋相同倍數后溶液的pH:②>① |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 過渡元素全部是金屬元素 | |
| B. | 同周期第ⅡA族與第ⅢA族元素的原子序數差值一定是1 | |
| C. | 催化劑一般在金屬與非金屬的分界線處尋找 | |
| D. | 同一主族元素的原子序數的差不可能為10 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 堿性溶液中:Na+、S2-、SO32-、AlO2- | |
| C. | 酸性溶液中:Na+、Fe2+、SO42-、NO3- | |
| D. | 加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com