
(1)下列關于工業生產說法正確的是 。(填序號)
| A.在侯氏制堿工業中,向飽和氯化鈉溶液中先通二氧化碳,后通氨氣 |
| B.在硫酸工業、合成氨工業、硝酸工業中,皆采用循環操作提高原料利用率 |
| C.在氯堿工業,電解槽被離子交換膜隔成陰極室和陽極室 |
| D.工業上采用電解熔融氯化鋁的方法制取金屬鋁 |
| pH | Ca2+ 、Mg2+總濃度 | 細菌總數 |
| 6.5~8.5 | < 0.004 5 mol·L-1? | <100個·mL-1? |

(15分)(1)BC(2分)(2)①HCO3-+OH-=CO32-+H2O, Mg2+ +2OH-=Mg(OH)2↓
Ca2+ + HCO3-+OH-=CaCO3↓+H2O (任選其二,其他合理寫法也對,每空2分)
②膠狀Fe(OH)3 (2分); 除去Ca2+ ; 調節pH (每空2分)
③殺菌消毒 (1分) ; a c e (2分)
解析試題分析:(1)A、因為氨氣溶解度非常大,先通氨氣后通二氧化碳,能增大二氧化碳的吸收,有利于生成純堿,故A步正確;
B、化學反應產物的循環利用可以提高原料利用率,故B正確;
C、電解飽和食鹽水時,在陰極上產生的是氫氣和氫氧化鈉,在陽極上產生的是氯氣,采用離子交換膜法,可防止陽極室產生的C12進入陰極室,所以選項C正確;
D、氯化鋁是共價化合物,熔融時不能導電,所以工業上采用電解熔融氧化鋁的方法制取金屬鋁,D不正確;
E、石油裂化屬于化學變化,主要目的是為了提高汽油的產量和質量,E不正確,答案選BC。
(2)①氫氧化鈣是強堿,能和氯化鎂反應生成氯化鈣和氫氧化鎂沉淀,化學反應的離子方程式是Mg2+ +2OH-=Mg(OH)2↓;氫氧化鈣也能和HCO3-反應生成CO32-,進而生成碳酸鈣沉淀,反應的離子方程式是HCO3-+OH-=CO32-+H2O和Ca2+ + HCO3-+OH-=CaCO3↓+H2O。
②亞鐵離子具有還原性,易被氧化生成鐵離子,鐵離子水解生成氫氧化鐵膠體,所以FeSO4·7H2O在水中最終生成膠狀Fe(OH)3沉淀。CO2是酸性氧化物,反應中氫氧化鈣過量,所以通入CO2的目的是除去過量的Ca2+和調節溶液的pH。
③氣體A的作用是殺菌消毒,其中具有強氧化性的物質是ClO2 、K2FeO4、漂白粉,所以可以代替A的消毒劑是選項ace。
考點:考查化工生產的有關判斷;水的凈化與處理等


科目:高中化學 來源: 題型:填空題
【化學--選修2化學與技術】(15分)
高鐵酸鉀(K2FeO4)是一種集氧化、吸附、絮凝于一體的新型多功能水處理劑。其生產工藝如下: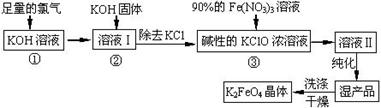
已知:2KOH + Cl2 ═ KCl + KClO + H2O(條件:溫度較低)
6KOH + 3Cl2 ═ 5KCl + KClO3 + 3H2O(條件:溫度較高)
回答下列問題:
(1)該生產工藝反應①應在 (填“溫度較高”或“溫度較低”)的情況下進行;
(2)寫出工業上制取Cl2的化學方程式 ;
(3)K2FeO4具有強氧化性的原因 ;
(4)配制KOH溶液時,是在每100 mL水中溶解61.6 g KOH固體( 該溶液的密度為1.47 g/mL),它
的物質的量濃度為 ;
(5)在“溶液I”中加KOH固體的目的是 :
| A.與 “溶液I” 中過量的Cl2繼續反應,生成更多的KClO |
| B.KOH固體溶解時會放出較多的熱量,有利于提高反應速率 |
| C.為下一步反應提供反應物 |
| D.使副產物KClO3轉化為 KClO |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
化工廠的設計是將實驗室的研究成果轉化為工業化生產的重要的基礎工作。
(1)以硫鐵礦為原料生產硫酸需經過 、 和 三個主要生產階段。
(2)侯氏制堿法是在索爾維制堿法的基礎上創造出的一種新的制造純堿的方法。具體工藝流程圖如下: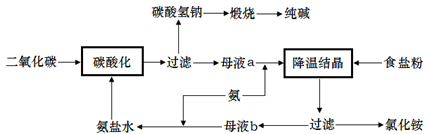
①索爾維制堿法的原理是 。(用化學方程式表示)
②侯氏制堿法與索爾維制堿法相比,優點是 。
③侯氏制堿法可以循環使用的物質有 。
(3)食鹽也是一種重要的化工原料,氯堿工業就是通過電解飽和食鹽水來制備NaOH、H2和C12。海水中得到的粗鹽中往往含有一些雜質,必須加入一些化學試劑,使雜質沉淀,處理后的鹽水還需進入陽離子交換塔,其原因是 。電解食鹽水在離子交換膜電解槽中進行,離子交換膜的作用是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業接觸法制硫酸的簡單流程圖如下: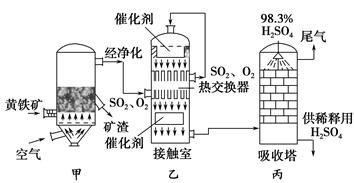
(1)寫出裝置甲的名稱________。要使黃鐵礦充分和迅速地燃燒,工業上常采取的措施為__________________________________。
(2)接觸室中二氧化硫與氧氣的反應采用________(填“常壓”或“高壓”),原因是________________________________。
(3)剛通入接觸室中的SO2和O2在熱交換器的管道________(填“里”或“外”)流動,在催化劑表面接觸反應的SO2和O2在熱交換器的管道________(填“里”或“外”)流動,這樣兩種流體通過管壁進行熱交換。
(4)在吸收塔中為什么用98.3%的濃硫酸而不是用水吸收三氧化硫?
______________________________________________________________。
(5)工業接觸法制硫酸的過程中,有兩個操作過程采用了逆流的原理,它們分別是_____________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
硝酸大量用于制造無機肥料,如硝酸銨、硝酸鈣、硝酸磷肥,還廣泛用于其他工業生產。硝酸工業生產流程圖如下圖所示: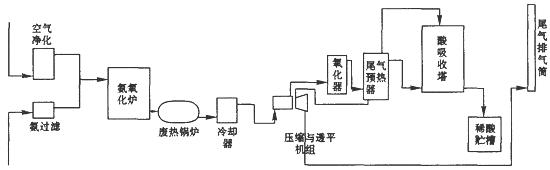
(1)第—步是氨的接觸氧化,在一定溫度下以鉑銠網作為催化劑,寫出該反應的化學方程式 。
(2)在吸收塔中用水循環吸收NO2得到硝酸,寫出發生該反應的化學方程式 ,該過程是放熱的,為了使吸收效果更好,在吸收過程中需要控制在 條件下。
(3)尾氣中含有氮的氧化物,直接排放到空氣中會危害環境,寫出一項氮的氧化物可能引起的環境問題 。工業上常用純堿溶液吸收NO2,生成亞硝酸鹽、硝酸鹽和其他物質,寫出該反應的化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
【化學與技術】
世界環保聯盟建議全面禁止使用氯氣用于飲用水的消毒,而建議采用高效“綠色”消毒劑二氧化氯。二氧化氯是一種極易爆炸的強氧化性氣體,易溶于水、不穩定、呈黃綠色,在生產和使用時必須盡量用稀有氣體進行稀釋,同時要避免光照、震動或加熱。實驗室以電解法制備ClO2的流程如下:請回答下列問題。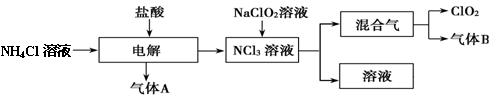
(1)ClO2中所有原子 (填“是”或“不是”)都滿足8電子結構。上圖所示電解法制得的產物中雜質氣體B能使石蕊試液顯藍色,除去雜質氣體可選用 。
A飽和食鹽水 B堿石灰 C濃硫酸 D蒸餾水
(2)穩定性二氧化氯是為推廣二氧化氯而開發的新型產品,下列說法正確的是 。
| A.二氧化氯可廣泛用于工業和飲用水處理 |
| B.應用在食品工業中能有效地延長食品貯藏期 |
| C.穩定性二氧化氯的出現大大增加了二氧化氯的使用范圍 |
| D.在工作區和成品儲藏室內,要有通風裝置和監測及警報裝置 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列說法不正確的是
| A.乙醇和二甲醚互為同分異構體,利用紅外光譜法或核磁共振氫譜法均可鑒別兩者 |
| B.乙酸乙醋在堿性條件下水解,屬于皂化反應 |
| C.使用含有氯化鈉的融雪劑會加快橋梁的腐蝕 |
| D.道爾頓首次提出原子學說、湯姆生發現電子、盧瑟福確定原子核的存在,都為原子結構理論的發展作出了巨大貢獻 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.氧化還原反應中一定有電子的得失或電子對的偏移 |
| B.由離子構成的物質一定是電解質,由分子構成的物質一定是非電解質 |
| C.玻璃鋼是一種新型的無機非金屬材料 |
| D.玻璃是一種新型的無機非金屬材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列化學肥料均屬于復合肥料的是( )。
| A.KH2PO4和NH4Cl | B.NH4Cl和NH4NO3 |
| C.KNO3和KH2PO4 | D.NH4Cl和KNO3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com