
乙烯催化氧化成乙醛可設計成如下圖所示的燃料電池,能在制備乙醛的同時獲得電能,其總反應為:2CH2 =CH2 + O2 → 2CH3CHO。下列有關說法正確的是( )
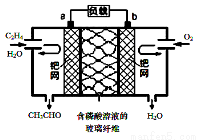
A.a電極發生還原反應
B.放電時,每轉移2mol電子,理論上需要消耗28g乙烯
C.b極反應式為:O2+4e-+2H2O=4OH-
D.電子移動方向:電極a→磷酸溶液→電極b
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:2015-2016學年河北省、永年二中高一下學期期中化學試卷(解析版) 題型:選擇題
下列敘述中,不正確的是( )
A.39K+和40Ca2+微粒中的電子數和中子數都相等
B.D2和He在同溫同壓時,若體積相等,則質量相等
C.同一元素的各種同位素的物理性質、化學性質均不相同
D.兩個質量數和電子數都相等的微粒不一定是同種元素
查看答案和解析>>
科目:高中化學 來源:2015-2016學年安徽黃山屯溪一中高二下期中文科化學試卷(解析版) 題型:選擇題
下列家庭化學小實驗不能達到預期目的的是
A.用米湯檢驗食用加碘鹽(含KIO3)中含有碘元素
B.用醋、石灰水驗證蛋殼中含有碳酸鹽
C.用碘酒檢驗汽油中是否含有不飽和烴
D.用雞蛋白、食鹽、水完成蛋白質的溶解、鹽析實驗
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江省高三第三次模擬理綜化學試卷(解析版) 題型:選擇題
鎂電池毒性低、污染小,電壓高且平穩,它逐漸成為人們研究綠色電池的關注焦點。其中一種鎂電池的反應原理為:xMg+ Mo3S4 MgxMo3S4,下列說法正確的是( )
MgxMo3S4,下列說法正確的是( )
A.放電時Mo3S4發生氧化反應
B.放電時,正極反應式為:Mo3S4 + 2xe- = Mo3S42x-
C.充電時,電路中通過2mol電子時,可消耗1mol Mg
D.充電時,Mg2+向負極移動
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江省高三考前訓練一理綜化學試卷(解析版) 題型:填空題
第21屆聯合國氣候大會于2015年11月30日在巴黎召開,會議的主題是減少溫室氣體排放量。
Ⅰ.CO2 加氫合成甲醇是合理利用 CO2 的有效途徑。由 CO2 制備甲醇過程可能涉及反應如下:
反應①:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H1=﹣49.58kJ•mol﹣1
CH3OH(g)+H2O(g)△H1=﹣49.58kJ•mol﹣1
反應②:CO2(g)+H2(g)  CO (g)+H2O(g)△H2
CO (g)+H2O(g)△H2
反應③:CO(g)+2H2(g)  CH3OH(g)△H3=﹣90.77kJ•mol﹣1,回答下列問題:
CH3OH(g)△H3=﹣90.77kJ•mol﹣1,回答下列問題:
(1)反應②的△H2= ,反應 ① 自發進行條件是 (填“較低溫”、“較高溫”或“任何溫度”)。
(2)某溫度下,在體積為2 L的恒容密閉容器中,按如下方式加入反應物,僅發生反應①。一段時間后達到平衡。
容器 | 甲 | 乙 |
反應物投入量 | 2mol CO2、6mol H2 | a mol CO2、b mol H2 c mol CH3OH(g)、c mol H2O(g) |
測得甲中CO2和CH3OH(g)的濃度隨時間變化如圖所示。
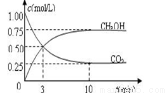
①前3min內,平均反應速率v(H2)= mol·L-1·min-1。此溫度下該反應的平衡常數為
(結果保留兩位小數) 。
②下列措施中,既能使反應速率加快,又能使n(CH3OH)/n(CO2)增大是 。
A.升高溫度 B.充入惰性氣體
C.將H2O(g)從體系中分離 D.再充入1mol H2
E.再充入1 mol CO2 F.加入催化劑
③反應達到平衡后,若向反應體系再加入CO2(g)、H2(g) 、CH3OH(g)、H2O(g)各1mol,化學平衡
(填“正向”、“逆向”或“不”)移動。
④要使平衡后乙與甲中相同組分的體積分數相等,且起始時維持化學反應向逆反應方向進行,則c的取值范圍為 。
Ⅱ.工業上可用CO2與NH3合成制尿素的原料氨基甲酸銨(H2NCOONH4)。氨基甲酸銨極易發生:H2NCOONH4+2H2O  NH4HCO3+NH3·H2O,該反應酸性條件下更徹底。25℃,向l L 0.1 mol·L-1的鹽酸中逐漸加入氨基甲酸銨粉末至溶液呈中性(忽略溶液體積變化),共用去0.052 mol氨基甲酸銨。若此時溶液中幾乎不含碳元素,則該溶液中 c(NH4+)=____________,NH4+水解常數Kh=________。
NH4HCO3+NH3·H2O,該反應酸性條件下更徹底。25℃,向l L 0.1 mol·L-1的鹽酸中逐漸加入氨基甲酸銨粉末至溶液呈中性(忽略溶液體積變化),共用去0.052 mol氨基甲酸銨。若此時溶液中幾乎不含碳元素,則該溶液中 c(NH4+)=____________,NH4+水解常數Kh=________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山東省高二下期中化學試卷(解析版) 題型:實驗題
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一種化工原料,常溫下為無色液體,不溶于水,沸點為142.4℃,密度比水小.某實驗小組利用如下裝置合成正丁醚(其它裝置均略去),發生的主要反應為:2C3CH2CH2CH2OH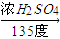 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
實驗過程如下:在容積為100mL的三頸燒瓶中將5mL濃硫酸、14.8g正丁醇和幾粒沸石混合均勻,再加熱回流一段時間,收集到粗產品,精制得到正丁醚。回答下列問題:
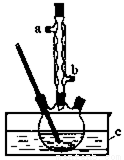
(1)合成粗產品時,液體試劑加入順序是_______。
(2)實驗中冷凝水應從_______口出去(填“a”或“b”).
(3)為保證反應溫度恒定在135℃,裝置C中所盛液體必須具有的物理性質為_______。
(4)加熱時間過長或溫度過高,反應混合液會變黑,寫出可能發生的有機副反應的化學方程式:_______,用NaOH溶液吸收有毒尾氣的離子方程式_______。
(5)得到的正丁醚粗產品依次用8mL 50%的硫酸、10mL水萃取洗滌。該步驟中需要的屬于硅酸鹽材質的實驗儀器是燒杯、玻璃棒、_______,將分離出的有機層用無水氯化鈣干燥,過濾后再進行_______(填操作名稱)精制得到正丁醚。
(6)本實驗最終得到6.50g正丁醚,則正丁醚的產率是_______。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山東省高二下期中化學試卷(解析版) 題型:選擇題
去甲腎上腺素可以調控動物機體的植物性神經功能,其結構簡式如圖所示,下列說法正確的是( )
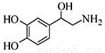
A.每個去甲腎上腺素分子中含有3個酚羥基
B.每個去甲腎上腺素分子中含有1個手性碳原子
C.1mol去甲腎上腺素最多與2mol Br2發生取代反應
D.去甲腎上腺素不能與鹽酸反應,又能與氫氧化鈉溶液反應
查看答案和解析>>
科目:高中化學 來源:2016屆湖南省等四校高三聯考化學試卷(解析版) 題型:實驗題
為驗證MnO2在KC1O3受熱分解制O2的反應前后質量不變,某興趣小組利用如圖所示裝置進行了如下實驗:

(1)連接好裝置后,如何檢查裝置的氣密性? 。
(2)取2.45 g KClO3固體粉末與0.87g MnO2粉末充分混勻,置于如圖所示裝置的試管中,充分加熱后,停止加熱,移去酒精燈之前,應先 ;調節量筒內液面與水槽內液面高度相同,量筒內收集到的氣體體積 0.735L(填“>” “<”或“=”)。已知室溫下氣體摩爾體積為24.5 L•mol-1,不考慮氧氣在水中的溶解及水蒸氣的影響)。
(3)取充分加熱后試管中的殘余固體,溶于50 mL 1.0 mol • L-1稀硫酸中,加入50 mL 0.30 mol • L-1 Na2C2O4 溶液,待與Mn02作用完畢后,用 0.10 mol • L-1 KMn04標準溶液進行滴定,消耗KMn04標準溶液V mL(已知Mn2+對滴定反應有催化作用)[
A.寫出Mn02與Na2C204反應的離子方程式 ;
B.當消耗KMnO4標準溶液的體積V= mL時,表明MnO2在反應前后質量不變。
C.若盛裝標準液的滴定管沒有用標準液潤洗,所測Mn02質量會 (填“偏大”、“偏小”或“不變”,下同);若滴定終點時明顯出現黑色沉淀,所測質量會 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年天津市高一下期中化學試卷(解析版) 題型:選擇題
下列反應中屬于加成反應的是
A乙烯使酸性KMnO4溶液褪色
B.將苯滴入溴水中,振蕩后水層接近無色
C.乙烯使溴水褪色
D.甲烷與氯氣混合,黃綠色消失
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com