
【題目】新型納米材料MFe2Ox(3<x<4)中M表示+2價的金屬元素,在反應中化合價不變化.常溫下,MFe2Ox能使工業廢氣中的SO2轉化為S,轉化過程表示如圖.下列說法正確的是( )
![]()
A.x<yB.SO2是該反應的催化劑
C.MFe2Ox是還原劑D.氧化性:MFe2Oy>SO2
 開心試卷期末沖刺100分系列答案
開心試卷期末沖刺100分系列答案 雙基同步導航訓練系列答案
雙基同步導航訓練系列答案 黃岡小狀元同步計算天天練系列答案
黃岡小狀元同步計算天天練系列答案科目:高中化學 來源: 題型:
【題目】綠礬(FeSO47H2O)在化學合成上用作還原劑及催化劑,工業上常用廢鐵屑溶于一定濃度的硫酸溶液制備綠礬。
(1)98% 1.84g/cm3的濃硫酸在稀釋過程中,密度下降,當稀釋至50%時,密度為1.4g/cm3,50%的硫酸物質的量濃度為______(保留兩位小數),50%的硫酸與30%的硫酸等體積混合,混合酸的濃度為______(填>、<、=)40%。
(2)實際生產用20%發煙硫酸(100克發煙硫酸含SO320克)配制稀硫酸,若用SO3nH2O表示20%的發煙硫酸,則n=______(保留兩位小數)。
(3)某廠廢水中含1.00×10﹣3mol/L的Cr2O72-,其毒性較大.某研究性學習小組為了變廢為寶,將廢水處理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合價為+3,Fe的化合價依次為+3、+2).欲使1L該廢水中的Cr2O72-完全轉化為Cr0.5Fe1.5FeO4.理論上需要加入______g FeSO47H2O。
(4)硫酸亞鐵銨[(NH4)2SO4FeSO46H2O](俗稱莫爾鹽),較綠礬穩定,在分析化學中常用來配制Fe2+的標準溶液,用此Fe2+的標準溶液可以測定剩余稀硝酸的量.現取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液處理,發生反應如下:
10NO3﹣+3Cu2S+16H+→6Cu2++10NO↑+3SO42﹣+8H2O
8NO3﹣+3CuS+8H+→3Cu2++3 SO42﹣+8NO↑+4H2O
剩余的稀硝酸恰好與48mL 2mol/L (NH4)2Fe(SO4)2溶液完全反應.
已知:NO3﹣+3Fe2++4H+→NO↑+3Fe3++2H2O
試計算混合物中CuS的質量分數(保留兩位小數)。______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】勒夏特列原理是自然界一條重要的基本原理,下列事實能用勒夏特列原理解釋的是
A. NO2氣體受壓縮后,顏色先變深后變淺
B. 對2HI(g) ![]() H2(g)+I2(g)平衡體系加壓,顏色迅速變深
H2(g)+I2(g)平衡體系加壓,顏色迅速變深
C. 合成氨工業采用高溫、高壓工藝提高氨的產率
D. 配制硫酸亞鐵溶液時,常加入少量鐵屑以防止氧化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2和CH4在一定條件下合成乙酸:CO2+CH4![]() CH3COOH。完成下列填空:
CH3COOH。完成下列填空:
(1)①寫出碳原子最外電子層的軌道表示式______
②鈦(Ti)是22號元素,它是______(選填編號)
a.主族元素 b.副族元素 c.短周期元素 d.長周期元素
(2)CS2分子的電子式為______;其熔沸點比CO2高,原因是______常溫下,向1L pH=10的 NaOH溶液中持續通入CO2。通入CO2的體積(V)與溶液中水電離產生的OH﹣離子濃度(c)的關系如圖所示
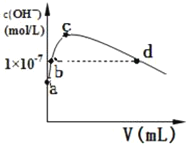
(3)c點溶液中離子濃度由大至小的關系是:______
(4)a點溶液中由水電離產生的c(H+)=______;b點溶液中c(H+)______1×10﹣7mol/L(填寫“等于”、“大于”或“小于”)
(5)能使0.1mol/L乙酸溶液的電離程度以及pH都增大的是______(選填序號)
a.加水稀釋 b.加入少量乙酸鈉固體 c.通氯化氫 d.加入少量苛性鈉固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】香料G的一種合成工藝如下圖所示。

已知:A的分子式為C5H8O,它有兩種不同環境的氫原子。
CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
完成下列填空:
(1)A的結構簡式為________________________________。
(2)D中官能團的名稱為____________________________。
(3)檢驗M已完全轉化為N的實驗操作是___________________________________________。
(4)E與濃硫酸共熱可制得H,H可制備一種高分子化合物Q。寫出Q的結構簡式_________。
(5)寫出滿足下列條件的L的兩種同分異構體的結構簡式(不考慮立體異構):__________。
①能發生銀鏡反應 ②能發生水解反應 ③苯環上的一氯代物有兩種
(6)以1-丁醇和NBS為原料可以制備順丁橡膠(![]() )。請設計合成路線(其他無機原料任選)并用如下方式表示:_____________________________。
)。請設計合成路線(其他無機原料任選)并用如下方式表示:_____________________________。
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 為元素周期表中前20號元素,其原子序數依次增大。其中
為元素周期表中前20號元素,其原子序數依次增大。其中![]() 、
、![]() 是金屬元素;
是金屬元素;![]() 和
和![]() 同主族,它們原子的最外層電子排布式均為
同主族,它們原子的最外層電子排布式均為![]() ;
;![]() 和
和![]() 同主族,它們原子最外層的
同主族,它們原子最外層的![]() 能級電子數是
能級電子數是![]() 能級電子數的2倍;
能級電子數的2倍;![]() 元素原子最外層電子數是
元素原子最外層電子數是![]() 元素原子最外層電子數的
元素原子最外層電子數的![]() 。已知五種元素的電負性為2.5、3.5、0.8、2.1、1.5,請回答下列問題:
。已知五種元素的電負性為2.5、3.5、0.8、2.1、1.5,請回答下列問題:
(1)![]() 是______(填元素符號,下同),
是______(填元素符號,下同),![]() 是______,
是______,![]() 是______,
是______,![]() 是______,
是______,![]() 是______。
是______。
(2)五種元素中金屬性最強的是______(填元素符號,下同),非金屬性最強的是______。
(3)當![]() 與
與![]() 、
、![]() 、
、![]() 分別形成化合物時,
分別形成化合物時,![]() 顯______(填“正”或“負”,下同)價,其他元素顯______價。
顯______(填“正”或“負”,下同)價,其他元素顯______價。
(4)當![]() 與
與![]() 、
、![]() 、
、![]() 、
、![]() 分別形成簡單化合物(其中
分別形成簡單化合物(其中![]() 、
、![]() 、
、![]() 、
、![]() 均顯最高價,
均顯最高價,![]() 顯最低負價)時,化合物中含有離子鍵的是______(填化學式,下同),含有共價鍵的是______。
顯最低負價)時,化合物中含有離子鍵的是______(填化學式,下同),含有共價鍵的是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒溫條件下,欲使CH3COONa的稀溶液中![]() 比值增大,可在溶液中加入少量下列物質中的( )
比值增大,可在溶液中加入少量下列物質中的( )
①固體NaOH ②固體KOH ③固體NaHSO4 ④固體CH3COONa ⑤冰醋酸
A.只有①②B.只有③⑤C.只有②④⑤D.只有①⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應A+B → C分兩步進行:①A+B →X,②X → C,能量變化如圖所示(E1、E2、E3均大于0),下列有關敘述正確的是

A.反應A+B→C的熱效應為 (E3 - E1) kJ
B.反應X→C為吸熱反應
C.X是反應A+B→C的催化劑
D.反應 A+B→X的熱效應為 - (E1 - E2) kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水溶液存在離子平衡,回答下列問題:
(1)Na2SO3水溶液呈________________(填“酸”、“中”、“堿”)性 ,原因是(用離子方程式):______________________________;
(2)已知T ℃時,純水中c(OH)為10-6 mol·L-1,則
①該溫度時0.1mol·L-1NaOH溶液pH為___________________。
②該溫度下,將pH=2 的H2SO4溶液與pH=9的NaOH溶液按體積比1:9混合(忽略溶液體積變化),所得混合溶液的pH為________
③該溫度下,若1體積pH1=a的某強酸溶液與10體積pH2=b的某強堿溶液混合后溶液呈中性(忽略溶液體積變化),則混合前,該強酸的pH1與強堿的pH2之間應滿足的關系是___________。
(3)常溫下,在25mL的氫氧化鈉溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲線如圖所示。
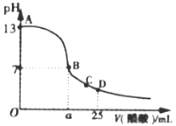
①在B點,溶液中n(CH3COO-)為______________________________。
②在D點,c(CH3COO) _________ c(Na+) (填“<”、“>”或“=”)。
③常溫下將0.02mol CH3COONa和0.01mol鹽酸溶于水,配成1L混合溶液。寫出溶液中各離子濃度的大小關系為___________________________。
(4)常溫下,在0.1mol·L-1硫酸銅溶液中加入氫氧化鈉稀溶液,充分攪拌有淺藍色氫氧化銅沉淀生成,當溶液pH為8時,c(Cu2+)=________。(已知常溫時Cu(OH)2的Ksp=2.2×10-20)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com