
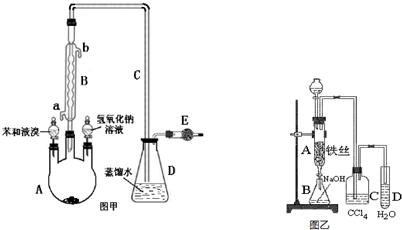
 .
. 分析 (Ⅰ)苯和液溴在鐵催化下反應生成溴苯和HBr,B用于冷凝回流,蒸餾水用于吸收HBr,堿石灰可吸收尾氣,防止污染環境;
(Ⅱ)由溴苯制備實驗裝置可知,苯與溴在三溴化鐵為催化劑時發生取代反應生成溴苯,反應的化學方程式為 ,B中NaOH吸收溴,與溴苯分層,C中四氯化碳吸收HBr中的溴單質,D中HBr溶于水,與硝酸銀反應生成AgBr沉淀,D中導管在液面上,可防止倒吸,以此來解答.
,B中NaOH吸收溴,與溴苯分層,C中四氯化碳吸收HBr中的溴單質,D中HBr溶于水,與硝酸銀反應生成AgBr沉淀,D中導管在液面上,可防止倒吸,以此來解答.
解答 解:(Ⅰ)(1)E中需加入的試劑是吸收溴化氫的固體物質堿石灰,故答案為:堿石灰;
(2)儀器B除導氣外的作用還起到冷凝回流反應物,使反應物充分利用;水逆流冷凝效果好應從a口流入,
故答案為:冷凝反應物使之回流;a;
(Ⅱ)(1)溴易溶于四氯化碳,不易溶于水,則C中盛放的四氯化碳的作用吸收HBr中的溴蒸氣,故答案為:吸收HBr中的溴蒸氣;
(2)實驗結束時,打開A下端的活塞,讓反應液流入B氫氧化鈉溶液中,吸收溴單質,充分振蕩靜置分層,利用分液漏斗分液分離出溴苯,
故答案為:Br2+2OH-=Br-+BrO-+H2O;分液漏斗;
(3)試管D中吸收的是溴化氫氣體,生成了溴化氫溶于水中電離出溴離子和銀離子,加入硝酸銀反應生成淡黃色沉淀溴化銀,說明溴單質和苯的反應是發生了取代反應,方程式為 ,
,
故答案為:淺黃色沉淀;取代; .
.
點評 本題考查有機物的制備實驗,為高頻考點,把握制備原理、有機物的性質、混合物分離提純為解答的關鍵,側重分析與實驗能力的考查,注意有機反應及混合物分離提純的應用,題目難度不大.


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:解答題
 甲醇是一種可再生的綠色能源,CO2是一種溫室氣體,它們都是重要的化工原料.
甲醇是一種可再生的綠色能源,CO2是一種溫室氣體,它們都是重要的化工原料.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 對于同類型反應,化學平衡常數K的大小反映了化學反應可能進行的程度 | |
| B. | 化學反應速率常數k與濃度無關,但受溫度、催化劑、固體表面性質等因素的影響 | |
| C. | 水的離子積常數Kw、電離平衡常數Ka與溫度有關,不受溶液的酸堿性影響 | |
| D. | 溶度積常數Ksp與難溶電解質的性質和溫度無關,只與沉淀的量有關 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 實驗步驟 | 預期現象和結論 |
| 步驟1:取少量懸濁液,過濾,充分洗滌后,取濾渣于試管中,加入過量2mol/L的鹽酸溶液,充分振蕩,再滴加幾滴0.1mol/L氯化鋇溶液 | 有白色沉淀生成說明懸濁液中混有Cu4(OH)6SO4. |
| 步驟2:另取少量懸濁液于試管中,將試管放入裝有沸水的小燒杯中水浴加熱一段時間取出試管觀察 | 試管中有黑色固體生成,說明懸濁液中混有Cu(OH)2. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
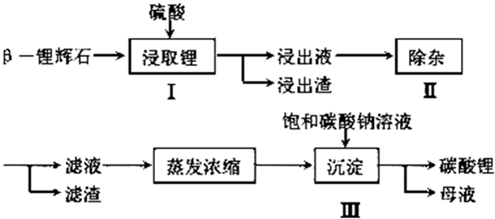
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
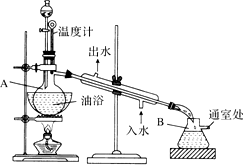 乙酸乙酯是無色的有水果香味的液體,沸點77.1℃,實驗室某次制取它用冰醋酸14.3mL,95%乙醇23mL,還用到濃H2SO4,飽和Na2CO3溶液以及極易與乙醇結合成六醇合物的氯化鈣溶液,主要儀器裝置如圖所示,實驗步驟是:①先向A蒸餾燒瓶中注入少量乙醇和所用的濃H2SO4后搖勻,再將剩下的所有乙醇和冰醋酸注入分液漏斗待用,這時分液漏斗里乙醇與冰醋酸的物質的量之比約為7:5;②加熱油浴,保持溫度在135℃~145℃之間;③將分液漏斗中的液體緩緩滴入蒸餾燒瓶里,調節加料速度使蒸出酯的速度與進料速度大體相等,直到加料完成;④保持油浴溫度一段時間,至不再有液體餾出后,停止加熱;⑤取下B吸濾瓶,將一定量飽和Na2CO3溶液分批少量多次地加到餾出液里,邊加邊搖蕩,直到無氣泡產生為止;⑥將⑤的液體混合物分液,棄去水層;⑦將飽和CaCl2溶液(適量)加入到分液漏斗中,搖蕩一段時間靜置,放出水層(廢液);⑧分液漏斗里得到的是初步提純的乙酸乙酯粗品;⑨然后再向其中加入無水硫酸鈉,振蕩.
乙酸乙酯是無色的有水果香味的液體,沸點77.1℃,實驗室某次制取它用冰醋酸14.3mL,95%乙醇23mL,還用到濃H2SO4,飽和Na2CO3溶液以及極易與乙醇結合成六醇合物的氯化鈣溶液,主要儀器裝置如圖所示,實驗步驟是:①先向A蒸餾燒瓶中注入少量乙醇和所用的濃H2SO4后搖勻,再將剩下的所有乙醇和冰醋酸注入分液漏斗待用,這時分液漏斗里乙醇與冰醋酸的物質的量之比約為7:5;②加熱油浴,保持溫度在135℃~145℃之間;③將分液漏斗中的液體緩緩滴入蒸餾燒瓶里,調節加料速度使蒸出酯的速度與進料速度大體相等,直到加料完成;④保持油浴溫度一段時間,至不再有液體餾出后,停止加熱;⑤取下B吸濾瓶,將一定量飽和Na2CO3溶液分批少量多次地加到餾出液里,邊加邊搖蕩,直到無氣泡產生為止;⑥將⑤的液體混合物分液,棄去水層;⑦將飽和CaCl2溶液(適量)加入到分液漏斗中,搖蕩一段時間靜置,放出水層(廢液);⑧分液漏斗里得到的是初步提純的乙酸乙酯粗品;⑨然后再向其中加入無水硫酸鈉,振蕩.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
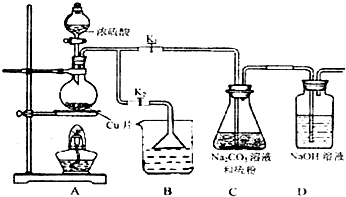
| 編號 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3標準溶液的體積/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 2SO2(g)+O2(g)?2SO3(g)反應過程中能量變化如圖所示(圖中E1表示正反應的活化能,E2表示逆反應的活化能).下列有關敘述正確的是( )
2SO2(g)+O2(g)?2SO3(g)反應過程中能量變化如圖所示(圖中E1表示正反應的活化能,E2表示逆反應的活化能).下列有關敘述正確的是( )| A. | △H=E2-E1 | |
| B. | 反應物斷鍵吸收的總能量小于生成物成鍵釋放的總能量 | |
| C. | 升高溫度,不影響活化分子百分數 | |
| D. | 使用催化劑使該反應的反應熱發生改變 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com