
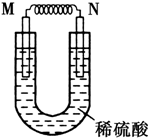
 由銅片、鐵片和200mL稀H2SO4組成的原電池中,若鐵片只發生電化學反應,則當N極上共放出5.6L (標準狀況)氣體時,H2SO4恰好完全消耗.
由銅片、鐵片和200mL稀H2SO4組成的原電池中,若鐵片只發生電化學反應,則當N極上共放出5.6L (標準狀況)氣體時,H2SO4恰好完全消耗.分析 (1)鐵與銅構成的原電池,活潑金屬鐵作負極,正極是氫離子放電生成氫氣,電子由負極流向正極,而N極上共放出氣體,所以N是正極;
(2)生成氫氣的物質的量為:$\frac{5.6L}{22.4L/mol}$=0.25mol,生成1mol的電子轉移電子數為2mol,由此分析解答;
(3)根據反應總方程式為:H2SO4~H2,由此分析解答.
解答 解:(1)鐵與銅構成的原電池,活潑金屬鐵作負極,正極是氫離子放電生成氫氣,電子由負極流向正極,而N極上共放出氣體,所以N是正極,則M電極材料為負極,M為電極材料為鐵,電極反應式為:Fe-2e-=Fe2+,原電池的電子是由鐵流向銅,故答案為:Fe;Fe-2e-=Fe2+; Fe;Cu;
(2)生成氫氣的物質的量為:$\frac{5.6L}{22.4L/mol}$=0.25mol,生成1mol的電子轉移電子數為2mol,所以轉移電子0.25mol×2=0.5mol,答:當反應結束時,導線上轉移電子的物質的量0.5mol;
(3)根據反應總方程式為:H2SO4~H2,所以n(H2SO4)=n(H2)=$\frac{0.25mol}{0.2L}$=1.25mol/L,答:稀H2SO4溶液的物質的量濃度是1.25mol/L.
點評 本題以原電池原理為載體,考查方程式的有關計算,題目難度不大,注意對基礎知識的理解掌握.


科目:高中化學 來源: 題型:選擇題
| A. | $\frac{KW}{c(H+)}$=1×10-13 mol•L-1的溶液中:Fe2+、K+、NO3-、SO42- | |
| B. | 使酚酞試液變紅色的溶液中:Na+、Ba2+、NO3-、Cl- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、Cl-、SCN-、SO42- | |
| D. | 水電離的c(H+)=1×10-13 mol•L-1的溶液中:K+、Na+、Br-、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NA個氮氣分子與NA個一氧化碳分子所含的電子數相等 | |
| B. | 在標準狀況下,1摩爾銅恰好與400ml 10mol/L的濃硝酸反應,可收集到22.4L的氣體 | |
| C. | 2mol•L-1 氨水溶液中含有2NA個NH4+ | |
| D. | 1mol氨氣溶于1升水中,所得溶液的濃度為1mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 石油主要含有碳、氫兩種元素 | B. | 石油屬于可再生礦物能源 | ||
| C. | 石油的裂化是化學變化 | D. | 石油分餾的各餾分均是純凈物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
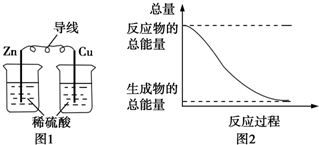
| A. | 圖1所示的裝置能將化學能轉變為電能 | |
| B. | 圖2所示的反應為吸熱反應 | |
| C. | 中和反應中,反應物的總能量比生成物的總能量低 | |
| D. | 化學反應中能量變化的主要原因是化學鍵的斷裂與生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該現象說明了NaHCO3難溶于水 | |
| B. | 濾液中的c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 濾液中c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 濾液中c(Cl-)>c(NH4+)>c(HCO3-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 60 g ZY2中含有2 mol Z-Y極性共價鍵 | |
| B. | Y的氫化物比R的氫化物穩定,熔沸點高 | |
| C. | Z、W、R最高價氧化物對應水化物的酸性強弱順序是:R>W>Z | |
| D. | X與Y形成的兩種常見化合物中陰、陽離子的個數比均為1:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用萃取法分離汽油和水的混合液 | |
| B. | 用結晶法提純NaC1和KNO3混合物中的KN03 | |
| C. | 直接蒸餾酒精溶液得到無水乙醇 | |
| D. | 除去FeC13溶液中少量的FeC12,加入足量的鐵屑,充分反應后,過濾 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 測定中和熱時,大小兩燒杯間填滿碎紙的作用只是固定小燒杯 | |
| B. | 用50mL 0.50mo1•L-1的氫氧化鈉溶液,分別與50mL 0.50mo1•L-1的鹽酸和50mL 0.25mo1•L-1的硫酸充分反應,兩反應測定的中和熱相等 | |
| C. | 不能用銅絲代替玻璃棒攪拌酸堿混合液 | |
| D. | 酸堿混合時,量筒中NaOH溶液應緩緩倒入小燒杯中,不斷用玻璃棒攪拌 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com