
由短周期元素形成的化合物有許多組成情況如果化學式為XY2,下列敘述正確的
A.如果XY2是共價化合物,則X與Y的原子序數不可能相差1
B.如果X與Y的原子序數相差6,則共價化合物XY2可溶于強堿溶液
C.如果X與Y的原子序數相差5,則離子化合物XY2不溶于水
D.如果XY2是離子化合物,則X與Y的原子序數可能相差9
 活力課時同步練習冊系列答案
活力課時同步練習冊系列答案 學業測評一課一測系列答案
學業測評一課一測系列答案科目:高中化學 來源:2015-2016學年山東省高一上學期第一次月考化學試卷(解析版) 題型:選擇題
鈉塊長時間暴露在空氣中的最終產物為
A.Na2O B.NaOH C.Na2CO3 D.Na2O2
查看答案和解析>>
科目:高中化學 來源:2016屆江蘇省宿遷市三校高三9月學情調研化學試卷(解析版) 題型:選擇題
短周期元素X、Y、Z、W、Q在元素周期表中的相對位置如圖所示。下列說法不正確的是

A.離子半徑的大小順序為:r(W2—)>r(Q—)>r(Y2—)>r(Z3+)
B.元素W的最高價氧化物對應水化物的酸性比Q的強
C.元素X的氫化物與Q的氫化物化合的產物中既含共價鍵又含離子鍵
D.X、Z、W、Q四種元素的最高價氧化物對應水化物均能與強堿反應
查看答案和解析>>
科目:高中化學 來源:2016屆湖南省高三第一次月考化學試卷(解析版) 題型:選擇題
今有一混合物的水溶液,可能大量含有以下離子中的若干種:K+、NH4+、Cl—、Mg2+、Ba2+、CO32-、SO42-,現取三份100mL溶液進行如下實驗:
(1)第一份加入AgNO3溶液有沉淀產生
(2)第二份加足量NaOH溶液加熱后,收集到氣體0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,經足量鹽酸洗滌、干燥后,沉淀質量為2.33g。
根據上述實驗,以下針對原溶液的推測正確的是
A.Cl—一定不存在 B.K+一定存在 C.Mg2+一定存在 D.Ba2+可能存在
查看答案和解析>>
科目:高中化學 來源:2016屆湖南省高三9月月考試化學試卷(解析版) 題型:實驗題
(14分)某研究性實驗小組欲驗證濃硝酸在與Cu、Ag合金的反應過程中除生成NO2氣體外,還會有少量NO生成、并測定Cu、Ag合金中Cu的質量分數.查閱相關資料表明:“常溫下,NO2與N2O4混合存在,在低于0℃時幾乎只有無色的N2O4液體或晶體存在.”為此,他們設計了如圖所示的裝置.
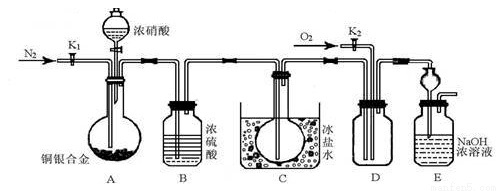
請回答下列問題
(1)寫出A中Cu與HNO3反應可能的化學方式 .
(2)實驗開始前先打開A部分的活塞K1,持續通入一段時間的氮氣再關閉K1,其目的是 ;裝置中B瓶的作用是 .
(3)停止反應后,打開D中的活塞K2并通入O2,若有NO生成,則D中出現的現象是 ;實驗發現,通入的O2溫度高低對實驗現象有較大影響,為便于觀察應通入(填“熱”或“冷”) 的O2.
(4)為減小實驗誤差,在A中反應完成和D中出現現象后,還應繼續進行的操作是 .
(5)實驗測得如下數據:實驗前,Cu、Ag合金的質量:15.0g,濃HNO3:40mL 13.5mol•L﹣1;實驗后A溶液:V=40mL c(H+)=1.0mol•L﹣1.假設反應中HNO3既無揮發也無分解,則:
①參加反應的HNO3的物質的量為 mol.
②若已測出反應后E裝置的生成物中含氮元素的質量,則為確定合金中Cu的質量分數還需測定的數據是 .
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三8月月考(開學摸底)化學試卷(解析版) 題型:選擇題
1.52 g銅鎂合金完全溶解于50 mL密度為1.40 g/mL、質量分數為63%的濃硝酸中,得到NO2和N2O4的混合氣體1120 mL(標準狀況),向反應后的溶液中加入1.0 mol/L NaOH溶液,當金屬離子全部沉淀時,得到2.54 g沉淀。下列說法不正確的是
A.得到2.54 g沉淀時,加入NaOH溶液的體積是700 mL
B.該合金中銅與鎂的物質的量之比是2:1
C.該濃硝酸中HNO3的物質的量濃度是14.0 mol/L
D.NO2和N2O4的混合氣體中,NO2的體積分數是80%
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三優錄班8月月考化學試卷(解析版) 題型:填空題
(15分)[選修3—物質結構與性質]釩(23V)是我國的豐產元素,廣泛用于催化及鋼鐵工業。回答下列問題:
(1)釩在元素周期表中的位置為 ,其價層電子排布圖為 。
(2) 釩的某種氧化物的晶胞結構如圖1所示。晶胞中實際擁有的陰、陽離子個數分別為 、 。
(3)V2O5常用作SO2 轉化為SO3的催化劑。SO2 分子中S原子價層電子對數是 對,分子的立體構型為 ;SO3氣態為單分子,該分子中S原子的雜化軌道類型為 ;SO3的三聚體環狀結構如圖2所示,該結構中S原子的雜化軌道類型為 ;該結構中S—O鍵長有兩類,一類鍵長約140pm,另一類鍵長約為160pm,較短的鍵為 (填圖2中字母),該分子中含有 個σ鍵。
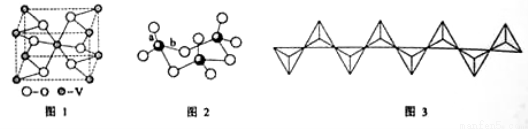
(4)V2O5 溶解在NaOH溶液中,可得到釩酸鈉(Na3VO4),該鹽陰離子的立體構型為 ;也可以得到偏釩酸鈉,其陰離子呈如圖3所示的無限鏈狀結構,則偏釩酸鈉的化學式為 ____ 。
查看答案和解析>>
科目:高中化學 來源:2016屆河南省濮陽市心高三上第一次市統摸底化學試卷(解析版) 題型:選擇題
設NA為阿伏伽德羅常數的數值,下列說法正確的是
A.常溫常壓下,14 g C2H4、C3H6的混合氣體中含有碳原子的數目為NA
B.常溫下,pH=12的Na2CO3溶液中含有的OH-離子數為0.01NA
C.標準狀況下,0.56 L丙烷中含有共價鍵的數目為0.2 NA
D.含0.2mol H2SO4的濃硫酸與足量銅反應,生成SO2的分子數為0.1NA
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省邯鄲市高二上第一次月考化學試卷(解析版) 題型:實驗題
(12分)某學生用已知物質的量濃度的鹽酸來測定未知物質的量濃度的NaOH溶液時,選擇甲基橙作指示劑。請填寫下列空白:
(1)用標準的鹽酸滴定待測的NaOH溶液時,左手握酸式滴定管的活塞,右手搖動錐形瓶,眼睛注視_____,直到因加入一滴鹽酸后,溶液由 色變為 色,并______為止。
(2)下列操作中可能使所測NaOH溶液的濃度數值偏低的是( )
A.酸式滴定管未用標準鹽酸潤洗就直接注入標準鹽酸
B.滴定前盛放NaOH溶液的錐形瓶用蒸餾水洗凈后沒有干燥
C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失
D.讀取鹽酸體積時,開始仰視讀數,滴定結束時俯視讀數
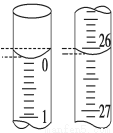
(3)若滴定開始和結束時,酸式滴定管中的液面如圖所示,則起始讀數為_____mL,終點讀數為_____mL,所用鹽酸溶液的體積為_____mL。
(4)某學生根據3次實驗分別記錄有關數據如下表:
滴定次數 | 待測NaOH溶液的體積/mL | 0.100 0 mol·L-1鹽酸的體積/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依據上表數據列式計算該NaOH溶液的物質的量濃度。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com