
【題目】若某電能與化學能的轉化裝置(電解池或原電池)中發生的總反應的離子方程式是 2Ag+2H+=2Ag++H2↑,則下列關于該裝置的有關說法正確的是
A. 該裝置可能是原電池,也可能是電解池
B. 該裝置只能是原電池,且電解質溶液為硝酸
C. 該裝置只能是電解池,且金屬銀為該電解池的陽極
D. 該裝置只能是原電池,電解質溶液不可能是鹽酸
科目:高中化學 來源: 題型:
【題目】乙酸乙酯是一種用途廣泛的精細化工產品。某課外小組設計實驗室制取并提純乙酸乙酯的方案如下:
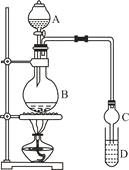
已知:①氯化鈣可與乙醇形成CaCl2·6C2H5OH
②有關有機物的沸點:
試劑 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸點/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制備過程
裝置如圖所示,A中放有濃硫酸,B中放有9.5mL無水乙醇和6mL冰醋酸,D中放有飽和碳酸鈉溶液。
(1)寫出乙酸與乙醇發生酯化反應的化學方程式 。
(2)實驗過程中滴加大約3mL濃硫酸,B的容積最合適的是 (填入正確選項前的字母)
A.25mL B.50mL C.250mL D.500mL
(3)球形干燥管的主要作用是 。
(4)預先向飽和Na2CO3溶液中滴加幾滴酚酞試液,目的是
。
Ⅱ.提純方法:①將D中混合液轉入分液漏斗進行分液。
②有機層用5mL飽和食鹽水洗滌,再用5mL飽和氯化鈣溶液洗滌,最后用水洗滌。有機層倒入一干燥的燒瓶中,用無水硫酸鎂干燥,得粗產物。
③將粗產物蒸餾,收集77.1℃的餾分,得到純凈干燥的乙酸乙酯。
(5)第①步分液時,選用的兩種玻璃儀器的名稱分別是 、 。
(6)第②步中用飽和食鹽水、飽和氯化鈣溶液、最后用水洗滌,分別主要洗去粗產品中的 , , 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外小組研究鋁土礦中Al2O3的含量。查閱資料得知,鋁土礦的主要成分是Al2O3,雜質是Fe2O3、SiO2等。從鋁土礦中提取Al2O3的過程如下:

(1)第①步,向鋁土礦中加入足量燒堿溶液,充分反應,發生反應的離子方程式是:______________ 、________________;
(2)第③步中,生成氫氧化鋁的離子方程式是_____________。若往A溶液中通入足量CO2,產生的沉淀為____________________(填化學式);
(3)工業上制取AlCl3常用Al2O3與C、Cl2在高溫條件下反應,已知每消耗0.5mol碳單質,轉移1mol電子,則該反應的氧化產物為_____________(填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某容器中發生一個化學反應,反應過程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六種離子.在反應過程中測得ClO-和N2的物質的量隨時間變化的曲線如圖所示.下列有關判斷中不正確的是( )
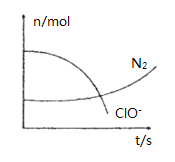
A. 還原劑是含CN-的物質,氧化產物只有N2
B. 氧化劑是ClO-,HCO3-是氧化產物
C. 參與反應的氧化劑與還原劑的物質的量之比為5:2
D. 標準狀況下若生成2.24LN2,則轉移電子1mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有X、Y、Z三種短周期元素,原子半徑由大到小的順序為Y>X>Z,原子序數之和為16.三種元素的常見單質在適當條件下可發生如圖所示的變化,其中B和C均為10電子分子.有關判斷不正確的是( )
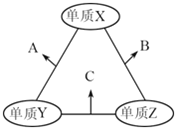
A. X元素位于ⅥA族 B. A不能溶解于B中 C. B的沸點高于C的沸點 D. A和C不可能發生氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的氧化物和硫的氧化物是導致酸雨的物質。
(1)SO2有毒,且能形成酸雨,是大氣主要污染物之一。石灰-石膏法和堿法是常用的煙氣脫硫法。石灰-石膏法的吸收原理:
①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2(CaSO4·2H2O)堿法的吸收原理:將含SO2的尾氣通入足量的燒堿溶液中,請寫出對應的化學反應方程式__________;
已知:
試劑 | Ca(OH)2 | NaOH |
價格(元/kg) | 0.36 | 2.9 |
和石灰-石膏法相比,堿法的優點是吸收快、效率高,缺點是__________;
(2)石灰-石膏法和堿法的基礎上,設計了雙堿法,能實現物料循環利用。

上述方法中,實現循環利用的物質是__________,請用化學方程式表示在Na2SO3溶液中加入CaO后的反應原理__________。
(3)一定條件下氨氣亦可用來將氮氧化物轉化為無污染的物質。寫出氨氣和二氧化氮在一定條件下反應的化學方程式:____________
(4)用氫氧化鈉溶液可以吸收廢氣中的氮氧化物,反應的化學方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
現有VL某NaOH溶液能完全吸收n mol NO2和m mol NO組成的大氣污染物。
①所用燒堿溶液的物質的量濃度至少為________mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,則原混合氣體中NO2和NO的物質的量之比n∶m=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是一種利用鋰電池“固定CO2”的電化學裝置,在催化劑的作用下,該電化學裝置放電時可將CO2轉化為C和Li2CO3,充電時選用合適催化劑,僅使Li2CO3發生氧化反應釋放出CO2和02。下列說法中正確的是

A. 該電池充電時,陽極反應式為:C+2Li2CO3-4e-=3CO2↑+4Li
B. 該電池放電時,Li+向電極X方向移動
C. 該電池充電時,電極Y與外接直流電源的負極相連
D. 該電池放電時,每轉移4mol電子,理論上生成1molC
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在圖(Ⅰ)所示的裝置中,燒杯中盛放的是Ba(OH)2溶液,當從滴定管中逐漸加入某種溶液A時,溶液的導電性的變化趨勢如圖(Ⅱ)所示。
(Ⅰ)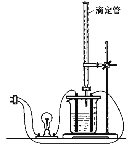 (Ⅱ)
(Ⅱ)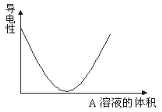
(1)滴加液體至圖(Ⅱ)中曲線最低點時,燈泡可能熄滅,可能的原因是______________。
(2)試根據離子反應的特點分析,溶液A中含有的溶質可能是(填序號)____________。
①HCl ②H2SO4 ③NaHSO4 ④NaHCO3
(3)已知0.1 mol·L-1NaHSO4溶液中c(H+)=0.1 mol·L-1,請回答下列問題:
①寫出NaHSO4在水溶液中的電離方程式_______________________________。
②NaHSO4屬于________(填“酸”、“堿”或“鹽”)。
③向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,請寫出發生反應的離子方程式:_______;在以上中性溶液中,繼續滴加Ba(OH)2溶液,請寫出此步反應的離子方程式:_________。寫出NaHSO4溶液與NaHCO3溶液混合的離子方程式_________。
(4)有以下物質:①石墨; ②氯化氫氣體; ③酒精; ④鋁; ⑤二氧化碳; ⑥碳酸氫鈉固體;⑦氫氧化鋇溶液; ⑧液態醋酸; ⑨氯化銀固體; ⑩氨氣。
①其中能導電的是:____________________________;
②屬于非電解質的是:__________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com