
【題目】NaHSO4與NaHCO3是兩種重要的酸式鹽。
(1)NaHSO4固體溶于水顯酸性,而NaHCO3固體溶于水顯堿性,請用離子方程式并配以必要的文字來說明NaHCO3固體溶于水顯堿性的原因___。
(2)常溫下把1mL0.2mol·L-1的NaHSO4溶液加水稀釋成2L溶液,此時溶液中由水電離產生的c(H+)為___。
(3)NaHSO4和NaHCO3兩溶液混合反應的離子方程式為___。
(4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,請寫出反應的離子方程式:___;在以上溶液中,繼續滴加Ba(OH)2溶液,此時反應的離子方程式為___。
(5)若將等體積、等物質的量濃度的NaHCO3溶液和Ba(OH)2溶液混合,反應的離子方程式為___。
【答案】NaHCO3=Na++![]() ,
,![]() +H2O
+H2O![]() H2CO3+OH-,
H2CO3+OH-,![]()
![]()
![]() +H+,且
+H+,且![]() 水解程度大于電離程度,故溶液呈堿性 1×10-10mol·L-1 H++
水解程度大于電離程度,故溶液呈堿性 1×10-10mol·L-1 H++![]() =H2O+CO2↑ 2H++
=H2O+CO2↑ 2H++![]() +Ba2++2OH-=BaSO4↓+2H2O
+Ba2++2OH-=BaSO4↓+2H2O ![]() +Ba2+=BaSO4↓
+Ba2+=BaSO4↓ ![]() +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
【解析】
NaHSO4固體溶于水只發生電離,而NaHCO3固體溶于水后電離產生的![]() 既能電離又能水解,但以水解為主;NaHSO4溶液加水稀釋,所得溶液中由水電離產生的c(H+)等于溶液中的c(OH-);NaHSO4和NaHCO3兩溶液混合,NaHSO4表現酸的性質與NaHCO3反應,生成二氧化碳氣體。NaHSO4、NaHCO3溶液中逐滴加入Ba(OH)2溶液,采用“以少定多”法確定反應的產物以及發生的反應。
既能電離又能水解,但以水解為主;NaHSO4溶液加水稀釋,所得溶液中由水電離產生的c(H+)等于溶液中的c(OH-);NaHSO4和NaHCO3兩溶液混合,NaHSO4表現酸的性質與NaHCO3反應,生成二氧化碳氣體。NaHSO4、NaHCO3溶液中逐滴加入Ba(OH)2溶液,采用“以少定多”法確定反應的產物以及發生的反應。
(1) NaHCO3固體溶于水后電離產生的![]() ,在溶液中主要發生水解,從而使溶液顯堿性,其原因為:NaHCO3=Na++
,在溶液中主要發生水解,從而使溶液顯堿性,其原因為:NaHCO3=Na++![]() ,
,![]() +H2O
+H2O![]() H2CO3+OH-,
H2CO3+OH-,![]()
![]()
![]() +H+,且
+H+,且![]() 水解程度大于電離程度,故溶液呈堿性。答案為:NaHCO3=Na++
水解程度大于電離程度,故溶液呈堿性。答案為:NaHCO3=Na++![]() ,
,![]() +H2O
+H2O![]() H2CO3+OH-,
H2CO3+OH-,![]()
![]()
![]() +H+,且
+H+,且![]() 水解程度大于電離程度,故溶液呈堿性;
水解程度大于電離程度,故溶液呈堿性;
(2)常溫下把1mL0.2mol·L-1的NaHSO4溶液加水稀釋成2L溶液,此時溶液中c(H+)=![]() =10-4mol/L,由水電離產生的c(H+)= c(OH-)溶液=
=10-4mol/L,由水電離產生的c(H+)= c(OH-)溶液=![]() mol/L=1×10-10mol·L-1。答案為:1×10-10mol·L-1;
mol/L=1×10-10mol·L-1。答案為:1×10-10mol·L-1;
(3)NaHSO4和NaHCO3兩溶液混合,反應生成Na2SO4、H2O、CO2,反應的離子方程式為H++![]() =H2O+CO2↑。答案為:H++
=H2O+CO2↑。答案為:H++![]() =H2O+CO2↑;
=H2O+CO2↑;
(4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,可設NaHSO4為1mol,則H+為1mol、![]() 為1mol,需OH-1mol,則加入Ba(OH)2為0.5mol,反應的離子方程式:2H++
為1mol,需OH-1mol,則加入Ba(OH)2為0.5mol,反應的離子方程式:2H++![]() +Ba2++2OH-=BaSO4↓+2H2O;由于
+Ba2++2OH-=BaSO4↓+2H2O;由于![]() 有剩余,在以上溶液中,繼續滴加Ba(OH)2溶液,又產生BaSO4沉淀,此時反應的離子方程式為
有剩余,在以上溶液中,繼續滴加Ba(OH)2溶液,又產生BaSO4沉淀,此時反應的離子方程式為![]() +Ba2+=BaSO4↓。答案為:2H++
+Ba2+=BaSO4↓。答案為:2H++![]() +Ba2++2OH-=BaSO4↓+2H2O;
+Ba2++2OH-=BaSO4↓+2H2O;![]() +Ba2+=BaSO4↓;
+Ba2+=BaSO4↓;
(5)若將等體積、等物質的量濃度的NaHCO3溶液和Ba(OH)2溶液混合,則生成BaCO3、NaOH、H2O,反應的離子方程式為![]() +Ba2++OH-=BaCO3↓+H2O。答案為:
+Ba2++OH-=BaCO3↓+H2O。答案為:![]() +Ba2++OH-=BaCO3↓+H2O。
+Ba2++OH-=BaCO3↓+H2O。


科目:高中化學 來源: 題型:
【題目】生產上用過量燒堿溶液處理某礦物![]() 含
含![]() 、
、![]() ,過濾后得到的濾液用
,過濾后得到的濾液用![]() 溶液處理,測得溶液的pH和
溶液處理,測得溶液的pH和![]() 生成的量隨加入
生成的量隨加入![]() 溶液體積變化的曲線如下圖所示。下列有關說法錯誤的是( )
溶液體積變化的曲線如下圖所示。下列有關說法錯誤的是( )
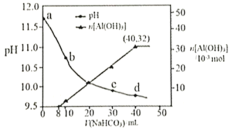
A.a點溶液中存在:![]()
B.水的電離程度:a點小于c點
C.原![]() 溶液中
溶液中![]()
D.生成沉淀的離子方程式為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在一容器內進行某一反應,M、N的物質的量隨反應時間變化的曲線如下圖所示,則下列敘述中,正確的是( )

A. 反應的化學方程式一定為2M![]() N
N
B. ![]() 時,逆反應速率一定大于正反應速率
時,逆反應速率一定大于正反應速率
C. ![]() 時,反應達到了化學平衡狀態
時,反應達到了化學平衡狀態
D. ![]() 時,正反應速率等于逆反應速率
時,正反應速率等于逆反應速率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下的定容容器中,反應:A(s)+2B(g)![]() C(g) +D(g)。下列不能表明反應
C(g) +D(g)。下列不能表明反應
達到平衡狀態的是( )。
A.氣體的壓強不變B.氣體平均相對分子質量不變
C.氣體的密度不變D.B物質的量濃度不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿式氯化銅[CuaClb(OH)cH2O]是一種重要的無機殺蟲劑,它可以通過以下步驟制備。步驟1:將銅粉加入稀鹽酸中,并持續通空氣反應后生成CuCl2。已知Fe3+對該反應有催化作用,其催化原理如圖所示

步驟2:在制得的CuCl2溶液中,加入石灰乳充分反應后即可制備堿式氯化銅。下列有關說法正確的是( )
A.a、b、c之間的關系式為:a=b+c
B.圖中M、N分別為Fe2+、Fe3+
C.步驟1充分反應后,加入CuO是為了除去Fe3+
D.若制備1molCuCl2,理論上消耗11.2LO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.幾種短周期元素的原子半徑及主要化合價如下表:已知X是短周期中最活潑的金屬,且與R同周期。
元素代號 | X | Y | Z | M | R |
原子半徑/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合價 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)M在元素周期表中的位置為________________。
(2)X與Y按原子個數比2∶1構成的物質的電子式為________________;所含化學鍵類型_________。
(3)X+、 Y2-、M2-離子半徑大小順序為_____________________________________。
(4)將YM2通入FeCl3溶液中的離子方程式:______________________________________。
Ⅱ.如下圖轉化關系:![]()
![]()
![]()
![]()
![]()
(1)若B為白色膠狀不溶物,則A與C反應的離子方程式為_______________________。
(2)若向B溶液中滴加鐵氰化鉀溶液會產生特征藍色沉淀,則A與C反應的離子方程式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是可逆反應![]() 在反應過程中的反應速率(v)與時間(t)的關系曲線,下列敘述正確的是( )
在反應過程中的反應速率(v)與時間(t)的關系曲線,下列敘述正確的是( )
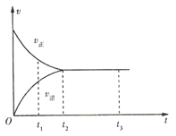
A.t1時,反應只向正方向進行B.t2時,反應未達到限度
C.t2~t3,反應已停止D.t2~t3,各物質的濃度不再發生變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國政府承諾到2020年單位GDP二氧化碳排放比2005年下降40%~45%。CO2可轉化成有機物實現碳循環。在體積為1L的密閉容器中充入1mol CO2和3mol H2,一定條件下發生反應:![]() ,測得CO2和CH3OH(g)的濃度隨時間的變化如圖所示。
,測得CO2和CH3OH(g)的濃度隨時間的變化如圖所示。
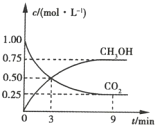
(1)3~9min內,v(H2)=_________mol·L-1·min-1。
(2)能說明上述反應達到平衡狀態的是________(填序號)。
A.反應中CO2與CH3OH的物質的量濃度之比為l:1(即圖中交點)
B.混合氣體的密度不隨時間的變化而變化
C.單位時間內消耗3mol H2,同時生成1mol CO2
D. CO2的體積分數在混合氣體中保持不變
(3)平衡時CO2的轉化率為________
(4)平衡時混合氣體中CH3OH(g)的體積分數為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國用BeO、KBF4等原料制備KBe2BO3F2晶體,在世界上首次實現在177.3 nm深紫外激光倍頻輸出,其晶胞如圖所示。下列說法錯誤的是( )
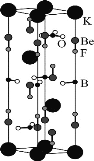
A. 構成晶體的非金屬元素的電負性由大到小的順序為F>O>B
B. KBF4中的陰離子的中心原子的雜化方式為sp2
C. 根據元素周期表中元素所處的位置可推測BeO與Al2O3性質相似
D. 晶胞中的K+有2個位于晶胞內部,8個位于晶胞頂點,則1mo1該晶胞含3molKBe2BO3F2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com