
【題目】質譜圖顯示,某化合物的相對分子質量為74;燃燒實驗發現,該化合物分子內碳、氫原子個數之比為2∶5;核磁共振氫譜顯示,該化合物分子中只有兩種類型的氫原子。下列關于該化合物的敘述不正確的是( )
A.該化合物可能為![]() 甲基
甲基![]() 丙醇B.該化合物為
丙醇B.該化合物為![]() 丁醇的同分異構體
丁醇的同分異構體
C.該化合物可能為乙醚D.該化合物為乙醚的同系物
科目:高中化學 來源: 題型:
【題目】十九大報告提出要對環境問題進行全面、系統的可持續治理。綠色能源是實施可持續發展的重要途徑,利用生物乙醇來制取綠色能源氫氣的部分反應過程如下圖所示:

(1)已知:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H1= - 41 kJ/mol
CO2(g)+H2(g) △H1= - 41 kJ/mol
CH3CH2OH(g)+3H2O(g) ![]() 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
請寫出反應I的熱化學方程式__________________________________________________________。
(2)反應II,在進氣比[n(CO) : n(H2O)]不同時,測得相應的CO平衡轉化率見下圖(各點對應的反應溫度可能相同,也可能不同;各點對應的其他反應條件都相同)。
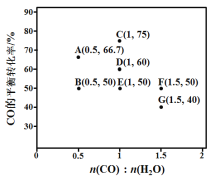
①經分析,A、E和G三點對應的反應溫度相同,其原因是KA=KE=KG=__________(填數值)。在該溫度下:要提高CO平衡轉化率,除了改變進氣比之外,還可采取的措施是_____
②對比分析B、E、F三點,可得出對應的進氣比和反應溫度的變化趨勢之間的關系是________
③比較A、B兩點對應的反應速率大小:VA________VB(填“<” “=”或“>”)。反應速率v=v正v逆= K正X(CO)![]() X(H2O) –K逆X( CO2)
X(H2O) –K逆X( CO2)![]() X(H2),K正、K逆分別為反應速率常數,X為物質的量分數,計算在達到平衡狀態為D點的反應過程中,當CO轉化率剛好達到20%時
X(H2),K正、K逆分別為反應速率常數,X為物質的量分數,計算在達到平衡狀態為D點的反應過程中,當CO轉化率剛好達到20%時
![]() =__________ (計算結果保留1位小數)。
=__________ (計算結果保留1位小數)。
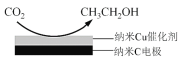
(3)反應III,利用碳酸鉀溶液吸收CO2得到飽和的KHCO3電解液,電解活化的CO2來制備乙醇。
①已知碳酸的電離常數Ka1=10-a,Ka2=10-b,吸收足量CO2所得飽和KHCO3溶液的pH=c,則該溶液中 =________(列出計算式)。
=________(列出計算式)。
②在飽和KHCO3電解液中電解CO2來制備乙醇的原理如圖所示。則陰極的電極反應式是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫時,改變弱酸RCOOH溶液的pH,溶液中RCOOH分子的物質的量分數δ(RCOOH)隨之改變,0.1mol/L甲酸(HCOOH)與丙酸(CH3CH2COOH)溶液中δ(RCOOH)與pH的關系如圖所示。下列說法正確的是( )
已知:δ(RCOOH)=![]()
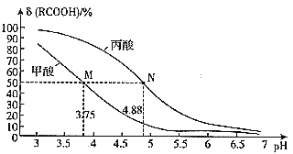
A.等濃度的HCOONa和CH3CH2COONa兩種溶液中水的電離程度比較:前者>后者
B.將等濃度的HCOOH溶液與HCOONa溶液等體積混合,所得溶液中:c(HCOOH)+2c(H+)>c(OH-)+c(HCOO-)
C.圖中M、N兩點對應溶液中的Kw比較:前者>后者
D.1mol/L丙酸的電離常數K﹤10-4.88
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
①、CH3—CH=CH2和CH2=CH2的最簡式相同 ②、 CH≡CH和C6H6含碳量相同
③、丁二烯和丁烯為同系物 ④、正戊烷、異戊烷、新戊烷的沸點逐漸變低
⑤、標準狀況下,11.2 L的庚烷所含的分子數為0. 5 NA(NA為阿伏加德羅常數)
⑥、能夠快速、微量、精確的測定相對分子質量的物理方法是核磁共振譜法
A.①和⑤B.②和③C.③⑤和⑥D.④和⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 是基本的有機化工原料。用A和常見的有機物可合成一種醚類香料和一種縮醛類香料(M)。具體合成路線如圖所示(部分反應條件略去):
是基本的有機化工原料。用A和常見的有機物可合成一種醚類香料和一種縮醛類香料(M)。具體合成路線如圖所示(部分反應條件略去):
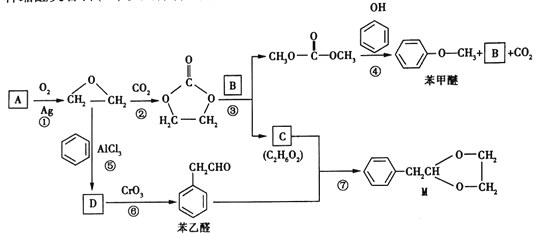
已知:①![]() 。
。
②D為單取代芳香族化合物且能與金屬鈉反應;每個D分子中只含有1個氧原子,D中氧元素的質量分數約為13.1%。試回答下列問題:
(1)A的名稱是_______,圖中縮醛(M)的分子式是______。
(2)B的結構簡式為___________。
(3)⑤的化學方程式為_____________。
(4)⑥的反應類型是___________。
(5)請寫出核磁共振氫譜有4組峰,且峰面積之比為3∶2∶2∶1,并含有苯環和![]() 結構的苯乙醛的所有同分異構體的結構簡式:_____________。
結構的苯乙醛的所有同分異構體的結構簡式:_____________。
(6)參照 的合成路線,設計一條由
的合成路線,設計一條由![]() 氯丙烷和必要的無機試劑制備
氯丙烷和必要的無機試劑制備 的合成路線(注明必要的反應條件):_________________________。
的合成路線(注明必要的反應條件):_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的氧化物是造成大氣污染的主要物質。研究氮氧化物的反應機理對于消除環境污染有重要意義。
(1)NO在空氣中存在如下反應:2NO(g)+O2(g)2NO2(g)△H,上述反應分兩步完成,其反應歷程如圖1所示, 回答下列問題:
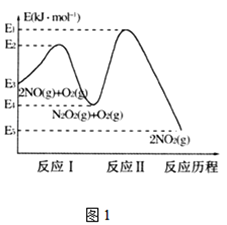
①寫出反應I的熱化學方程式________________。
②反應I和反應Ⅱ中,一個是快反應,會快速建立平衡狀態,而另一個是慢反應。決定2NO(g)+O2(g)![]() 2NO2(g)反應速率的是___(填“反應I”或“反應Ⅱ”);對該反應體系升高溫度,發現總反應速率反而變慢,其原因可能是_____________(反應未使用催化劑)。
2NO2(g)反應速率的是___(填“反應I”或“反應Ⅱ”);對該反應體系升高溫度,發現總反應速率反而變慢,其原因可能是_____________(反應未使用催化劑)。
(2)用活性炭還原法也可處理氮氧化物。有關反應為:2C(s)+2NO2(g)![]() N2(g)+2CO2(g),起始時向密閉容器中充入一定量的C(s)和NO2(g),在不同條件下,測得各物質的濃度變化狀況如下圖所示。
N2(g)+2CO2(g),起始時向密閉容器中充入一定量的C(s)和NO2(g),在不同條件下,測得各物質的濃度變化狀況如下圖所示。

①0~10min,1020 min,3040 min三個階段NO2的轉化率分別為α1、α2、α3,其中最小的為_________,其值是___________________。
②計算反應達到第一次平衡時的平衡常數K=____________。
③第10min時,若只改變了影響反應的一個條件,則改變的條件為______(填選項字母)。
A.增加C(s)的量 B.減小容器體積 C.加入催化劑
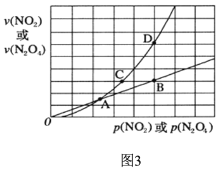
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g)△H<0,在圖3標出點中,指出能表示反應達到平衡狀態的點是________,理由是________________。
N2O4(g)△H<0,在圖3標出點中,指出能表示反應達到平衡狀態的點是________,理由是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】輝銅礦(主要成分Cu2S)作為銅礦中銅含量最高的礦物之一,可用來提煉銅和制備含銅化合物。
Ⅰ.濕法煉銅用Fe2(SO4)3溶液作為浸取劑提取Cu2+:
(1)反應過程中有黃色固體生成,寫出反應的離子方程式______________________。
(2)控制溫度為85℃、浸取劑的pH = 1,取相同質量的輝銅礦粉末分別進行如下實驗:
實驗 | 試劑及操作 | 3小時后Cu2+浸出率(%) |
一 | 加入10mL 0.25mol·L-1Fe2(SO4)3溶液和5 mL水 | 81.90 |
二 | 加入10 mL0.25mol·L-1Fe2(SO4)3溶液和5mL 0.1mol·L-1H2O2 | 92.50 |
回答:H2O2使Cu2+浸出率提高的原因可能是__________。
(3)實驗二在85℃后,隨溫度升高,測得3小時后Cu2+浸出率隨溫度變化的曲線如圖。Cu2+浸出率下降的原因_________________。

(4)上述濕法煉銅在將銅浸出的同時,也會將鐵雜質帶進溶液,向浸出液中通入過量的O2并加入適量的CuO,有利于鐵雜質的除去,用離子方程式表示O2的作用_________。解釋加入CuO的原因是_____。
Ⅱ.某課題組利用碳氨液((NH4)2CO3、NH3·H2O)從輝銅礦中直接浸取銅。

其反應機理如下:
①Cu2S(s)2Cu+(aq) +S2-(aq) (快反應)
②4Cu++O2+2H2O4Cu2++4OH- (慢反應)
③Cu2++4NH3·H2OCu(NH3)42++4H2O(快反應)
(5)提高銅的浸出率的關鍵因素是 ________。
(6)在浸出裝置中再加入適量的(NH4)2S2O8,銅的浸出率有明顯升高,結合平衡移動原理說明可能的原因是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.將1mol Cl2通入水中,HClO、Cl-、ClO-粒子數之和為![]()
B.密閉容器中2molNO與1molO2充分反應,產物的分子數為2NA
C.1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-離子數之和為0.1NA
D.某電池的總反應為Fe+2Fe3+=3Fe2+,當有5.6gFe溶解時電路中有0.2mol e-通過
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com