
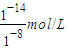 =10-6 mol/L,0.1mol?L-1NaOH溶液中c(H+)等于由水電離出的氫氧根離子濃度,即c(H+)=c(OH-)(水電離出的)=
=10-6 mol/L,0.1mol?L-1NaOH溶液中c(H+)等于由水電離出的氫氧根離子濃度,即c(H+)=c(OH-)(水電離出的)=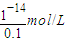 =10-13 mol/L,所以混合液中由水電離出的OH-濃度與0.1mol?L-1NaOH溶液中由水電離出的OH-濃度之比=10-6 mol/L:10-13 mol/L=107:1,故答案為:107:1;
=10-13 mol/L,所以混合液中由水電離出的OH-濃度與0.1mol?L-1NaOH溶液中由水電離出的OH-濃度之比=10-6 mol/L:10-13 mol/L=107:1,故答案為:107:1; ×0.1mol?L-1=0.05mol?L-1,;[H+]=[OH-]=1×10-7 mol?L-1(因為是25℃下且為中性),故混合后溶液中c(NH3.H2O)=
×0.1mol?L-1=0.05mol?L-1,;[H+]=[OH-]=1×10-7 mol?L-1(因為是25℃下且為中性),故混合后溶液中c(NH3.H2O)= ×amol?L-1-0.05mol?L-1=(0.5a-0.05)mol/L,NH3?H2O的電離常數Kb=
×amol?L-1-0.05mol?L-1=(0.5a-0.05)mol/L,NH3?H2O的電離常數Kb= mol/L=
mol/L=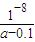 mol/L,
mol/L,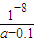 .
.

科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 10-8 |
| a-0.1 |
| 10-8 |
| a-0.1 |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年山東省濱州市高三第一次(3月)模擬考試理綜化學試卷(解析版) 題型:計算題
(l)常溫下,如果取0.1mol·L-1HA溶液與0.1mol·L-1 NaOH溶液等體積混合,測得混合液的pH=8。混合液中由水電離出的OH-濃度與0.1mol·L-1 NaOH溶液中由水電離出的OH-濃度之比為 。
(2)相同溫度下,將足量硫酸鋇固體分別放入相同體積的①0.1mol·L-1硫酸鋁溶液
②0.1mol·L-1氯化鋇溶液③蒸餾水④0.1mol·L-1硫酸溶液中,Ba2+濃度由大到小的順序是 。(用序號填寫)
(3)常溫下,將a mol·L-1的氨水與0.1mol·L-1的鹽酸等體積混合,當溶液中c(NH4+)=c(Cl-)時,用含a的代數式表示NH3·H2O的電離常數 =
mol·L-1。
=
mol·L-1。
查看答案和解析>>
科目:高中化學 來源:濱州一模 題型:問答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com