
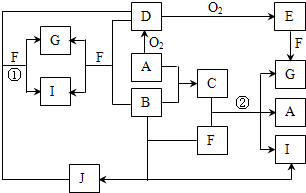
 由短周期元素組成的10種物質A~J之間有下圖關系.已知:A、B為同周期相鄰元素的單質,其余均為化合物;通常情況下A為固體,B、D為氣體且B呈黃綠色,F為液體,A和G的濃溶液加熱時反應生成D和F,J在光照時有I生成.
由短周期元素組成的10種物質A~J之間有下圖關系.已知:A、B為同周期相鄰元素的單質,其余均為化合物;通常情況下A為固體,B、D為氣體且B呈黃綠色,F為液體,A和G的濃溶液加熱時反應生成D和F,J在光照時有I生成.| 實驗步驟 | 實驗現象 | 用化學用語解釋 |
| 將少量氣體通 入淀粉KI溶液 | 溶液最初變成______色 | ______ (用離子方程式表示) |
| 繼續通入氣體 | 溶液逐漸變成無色 | ______ (用化學方程式表示) |
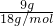 =0.5mol;n(SO3)=
=0.5mol;n(SO3)=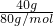 =0.5mol;依據熱化學方程式的書寫方法標注物質聚集狀態,反應的反應焓變,則表示該反應的熱化學方程式為:SO3(g)+H2O(l)=H2SO4(l);△H=-130.3 kJ/mol;
=0.5mol;依據熱化學方程式的書寫方法標注物質聚集狀態,反應的反應焓變,則表示該反應的熱化學方程式為:SO3(g)+H2O(l)=H2SO4(l);△H=-130.3 kJ/mol; ;故答案為:
;故答案為: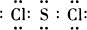
 MnCl2+Cl2↑+2H2O;將少量氣體Cl2通入淀粉KI溶液中反應生成碘單質,單質碘遇淀粉變藍;反應的離子方程式為:Cl2+2I-=2Cl-+I2;繼續通入氣體Cl2,溶液逐漸變成無色,說明碘單質被通入的氯氣氧化為高價態的化合物,依據電子守恒計算得到,整個反應過程中,每消耗0.1mol KI,轉移的電子數約為3.612×1023個,物質的量為0.6mol;反應Cl2+2I-=2Cl-+I2;0.1molI-被氧化轉移電子數為0.1mol;生成I2物質的量為0,05mol,設碘單質變化合價升高為x價,I2~2I~2x;得到2x×0.05mol=0.5mol;x=5,所以碘單質被氧化為+5甲碘酸,依據原子守恒和配平方法寫出化學方程式為:5Cl2+I2+6H2O=10HCl+2HIO3;故答案為:5Cl2+I2+6H2O=10HCl+2HIO3;
MnCl2+Cl2↑+2H2O;將少量氣體Cl2通入淀粉KI溶液中反應生成碘單質,單質碘遇淀粉變藍;反應的離子方程式為:Cl2+2I-=2Cl-+I2;繼續通入氣體Cl2,溶液逐漸變成無色,說明碘單質被通入的氯氣氧化為高價態的化合物,依據電子守恒計算得到,整個反應過程中,每消耗0.1mol KI,轉移的電子數約為3.612×1023個,物質的量為0.6mol;反應Cl2+2I-=2Cl-+I2;0.1molI-被氧化轉移電子數為0.1mol;生成I2物質的量為0,05mol,設碘單質變化合價升高為x價,I2~2I~2x;得到2x×0.05mol=0.5mol;x=5,所以碘單質被氧化為+5甲碘酸,依據原子守恒和配平方法寫出化學方程式為:5Cl2+I2+6H2O=10HCl+2HIO3;故答案為:5Cl2+I2+6H2O=10HCl+2HIO3;

 高中必刷題系列答案
高中必刷題系列答案科目:高中化學 來源: 題型:



| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
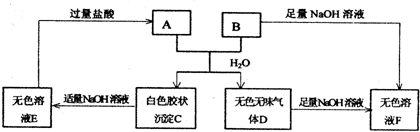
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 (2010?西城區一模)甲、乙、丙、丁是由短周期元素組成的物質,它們之間存在如下轉化關系.甲+乙→丙+丁
(2010?西城區一模)甲、乙、丙、丁是由短周期元素組成的物質,它們之間存在如下轉化關系.甲+乙→丙+丁

| ||
| ||
| 2 |
| 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 甲、丙、丁是由短周期元素組成的物質,它們之間存在如下轉化關系.
甲、丙、丁是由短周期元素組成的物質,它們之間存在如下轉化關系.

| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
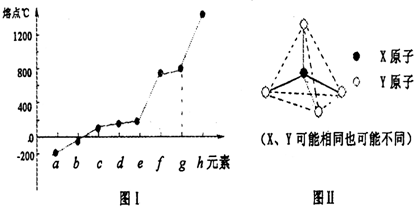
| 氫化物 | 沸點℃ |
| A | 1317 |
| B | 100 |
| C | 19.5 |
| D | -33 |
| E | -162 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com