
【題目】把由NaOH、AlCl3、MgCl2三種固體組成的混合物,溶于足量水中后有0.58g白色沉淀生成,在所得的渾濁液中,逐滴加入0.5mol/L鹽酸,加入鹽酸的體積(V)與生成沉淀的質量(W)關系如右圖所示:
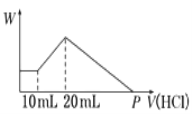
(1)混合物中NaOH的質量為_________________
(2)混合物中MgCl2的質量為_________________
(3)混合物中AlCl3的物質的量為_________________
(4)P點表示鹽酸的體積是_________________
【答案】 1.8g 0.95g 0.005mol 90mL
【解析】試題分析:本題考查與Mg(OH)2、Al(OH)3有關的圖像分析和混合物的計算。由圖像知,開始加入10mL鹽酸,沉淀既不增加也不減少,所以渾濁液中含NaOH;則NaOH、AlCl3、MgCl2的固體混合物溶于水時發生的反應為:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+4NaOH=3NaCl+NaAlO2+2H2O;0.58g沉淀為Mg(OH)2。根據Mg守恒,n(MgCl2)=n[Mg(OH)2]= ![]() =0.01mol;根據圖像知,加入10mL~20mL鹽酸時發生的反應為NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,n(NaAlO2)=n[Al(OH)3]=0.5mol/L
=0.01mol;根據圖像知,加入10mL~20mL鹽酸時發生的反應為NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,n(NaAlO2)=n[Al(OH)3]=0.5mol/L![]() 0.01L=0.005mol,根據Al守恒,n(AlCl3)=n(NaAlO2)=0.005mol。
0.01L=0.005mol,根據Al守恒,n(AlCl3)=n(NaAlO2)=0.005mol。
(1)當加入20mL鹽酸沉淀量達最大,發生的反應為NaOH+HCl=NaCl+H2O、NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,此時溶液中的溶質為NaCl,根據Na、Cl守恒,Na全部來自NaOH,Cl來自MgCl2、AlCl3和加入的20mL的鹽酸,混合物中n(NaOH)=2n(MgCl2)+3n(AlCl3)+0.5mol/L![]() 0.02L=2
0.02L=2![]() 0.01mol+3
0.01mol+3![]() 0.005mol+0.01mol=0.045mol,m(NaOH)=0.045mol
0.005mol+0.01mol=0.045mol,m(NaOH)=0.045mol![]() 40g/mol=1.8g。
40g/mol=1.8g。
(2)混合物中m(MgCl2)=0.01mol![]() 95g/mol=0.95g。
95g/mol=0.95g。
(3)混合物中AlCl3物質的量為0.005mol。
(4)沉淀達最大時,沉淀由Mg(OH)2和Al(OH)3組成;溶解Mg(OH)2發生的反應為Mg(OH)2+2HCl=MgCl2+2H2O,溶解Mg(OH)2消耗HCl物質的量為2n[Mg(OH)2]=2![]() 0.01mol=0.02mol;溶解Al(OH)3發生的反應為Al(OH)3+3HCl=AlCl3+3H2O,溶解Al(OH)3消耗HCl物質的量為3n[Al(OH)3]=3
0.01mol=0.02mol;溶解Al(OH)3發生的反應為Al(OH)3+3HCl=AlCl3+3H2O,溶解Al(OH)3消耗HCl物質的量為3n[Al(OH)3]=3![]() 0.005mol=0.015mol;沉淀完全溶解消耗的HCl物質的量為0.02mol+0.015mol=0.035mol,消耗鹽酸的體積為0.035mol
0.005mol=0.015mol;沉淀完全溶解消耗的HCl物質的量為0.02mol+0.015mol=0.035mol,消耗鹽酸的體積為0.035mol![]() 0.5mol/L=0.07L=70mL,P點表示鹽酸的體積為20mL+70mL=90mL。
0.5mol/L=0.07L=70mL,P點表示鹽酸的體積為20mL+70mL=90mL。


 開心蛙狀元作業系列答案
開心蛙狀元作業系列答案 課時掌控隨堂練習系列答案
課時掌控隨堂練習系列答案 一課一練一本通系列答案
一課一練一本通系列答案科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符的是( )
A.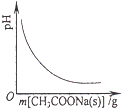 向CH3COOH溶液中逐步加入CH3COONa固體后,溶液pH的變化
向CH3COOH溶液中逐步加入CH3COONa固體后,溶液pH的變化
B.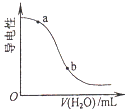 向CH3COOH溶液中加水時溶液的導電性變化,則CH3COOH溶液的pH:a>b
向CH3COOH溶液中加水時溶液的導電性變化,則CH3COOH溶液的pH:a>b
C.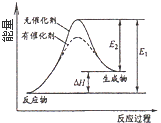 催化劑能改變化學反應的焓變
催化劑能改變化學反應的焓變
D.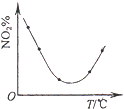 等量NO2在容積相同的恒容密閉容器中,不同溫度下分別發生反應:2NO2(g)N2O4(g),相同時間后測得NO2含量的曲線,則該反應的△H<0
等量NO2在容積相同的恒容密閉容器中,不同溫度下分別發生反應:2NO2(g)N2O4(g),相同時間后測得NO2含量的曲線,則該反應的△H<0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常見有機反應類型有①加聚②加成 ③氧化 ④酯化或取代 ⑤取代,請用序號填寫,甲烷與氯氣在光照條件下的反應是_________反應,乙烯與溴水的反應是________反應,乙烯使高錳酸鉀溶液褪色的反應是_________反應,乙酸和乙醇在一定條件下制取乙酸乙酯的反應是________反應,乙烯制取聚乙烯的反應是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫化鈉主要用于皮革、毛紡、高檔紙張、染料等行業.生產硫化鈉大多采用無水芒硝(Na2SO4)﹣炭粉還原法,其流程示意圖如圖1: 
(1)上述流程中“堿浸”后,物質A必須經過(填寫操作名稱)處理后,方可“煅燒”;若煅燒所得氣體為等物質的量的CO和CO2 , 寫出煅燒時發生的總的化學反應方程式為 .
(2)上述流程中采用稀堿液比用熱水更好,理由是 .
(3)取硫化鈉晶體(含少量NaOH)加入到硫酸銅溶液中,充分攪拌.若反應后測得溶液的pH=4,則此時溶液中c( S2﹣)= . (已知:常溫時CuS、Cu(OH)2的Ksp分別為8.8×10﹣36、2.2×10﹣20)
(4)①皮革工業廢水中的汞常用硫化鈉除去,汞的去除率與溶液的pH和x(x代表硫化鈉的實際用量與理論用量的比值)有關(如圖2所示).為使除汞效果最佳,應控制的條件是、 . ②某毛紡廠廢水中含0.001 molL﹣1的硫化鈉,與紙張漂白后的廢水(含0.002 molL﹣1 NaClO)按1:2的體積比混合,能同時較好處理兩種廢水,處理后的廢水中所含的主要陰離子有 . 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據英國《自然》雜志報道,科學家最近研制成了以鍶原子做鐘擺的“光晶格鐘”,成了世界上最精確的鐘。已知一種鍶原子的相對原子質量為88,其質子數是38,則這種鍶原子的中子數為
A.38B.50C.88D.126
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室利用右圖所示裝置進行NaHCO3的受熱分解實驗。請回答:

(1)加熱一段時間后,燒杯中觀察到的實驗現象是__________________________
(2)實驗結束時的正確操作是____(填字母);
A.先從液體中移出導管,再熄滅酒精燈
B.先熄滅酒精燈,再從液體中移出導管。
否則會引起___________。
(3)NaHCO3受熱分解的化學方程式________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫能的存儲是氫能應用的主要瓶頸,目前所采用或正在研究的主要儲氫材料有:配位氫化物、富氫載體化合物、碳質材料、金屬氫化物等.
(1)Ti(BH4)2是一種過渡元素硼氫化物儲氫材料. ①Ti2+基態的外圍電子排布式可表示為 .
②BH4﹣的空間構型是(用文字描述).
(2)液氨是富氫物質,是氫能的理想載體,利用N2+3H2 ![]() 2NH3實現儲氫和輸氫.下列說法正確的是(多項選擇).
2NH3實現儲氫和輸氫.下列說法正確的是(多項選擇).
A.NH3分子中N原子采用sp3雜化
B.相同壓強時,NH3沸點比PH3高
C.[Cu(NH3)4]2+離子中,N原子是配位原子
D.CN﹣的電子式為[:C┇┇N:]﹣
(3)2008年,Yoon等人發現Ca與C60(分子結構如圖1)生成的Ca32C60能大量吸附H2分子. ①C60晶體易溶于苯、CS2 , C60是分子(填“極性”或“非極性”).
②1mol C60分子中,含有σ鍵數目為 .
(4)一種由Mg和H元素組成的物質是金屬氫化物儲氫材料,其晶胞結構如圖2所示,該物質化學式為 . 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學采用硫鐵礦焙燒取硫后的燒渣(主要成分為Fe2O3、SiO2、Al2O3 , 不考慮其他雜質)制取綠礬(FeSO47H2O),設計了如下流程,下列說法不正確的是( )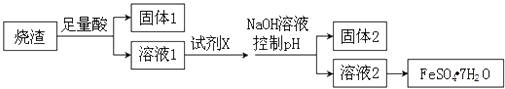
A.溶解燒渣選用足量硫酸,試劑X選用鐵粉
B.固體1中一定含有SiO2 , 控制pH是為了使Al3+轉化為Al(OH)3 , 進入固體2
C.若改變方案,在溶液1中直接加NaOH至過量,得到的沉淀用硫酸溶解,其溶液經結晶分離也可得到FeSO47H2O
D.從溶液2得到FeSO47H2O產品的過程中,須控制條件防止其氧化和分解
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com