
【題目】現有部分短周期元素的性質或原子結構如表:
元素編號 | 元素性質或原子結構 |
T | M層上有6個電子 |
X | 最外層電子數是次外層電子數的2倍 |
Y | 常溫下單質為雙原子分子,其氫化物水溶液呈堿性 |
Z | 元素最高正價是+7價 |
W | 其單質既能跟酸反應,又能跟強堿反應,都產生H2 |
(1)元素X的一種同位素可測定文物年代,這種同位素的符號是_____。
(2)元素Y與氫元素形成一種離子YH4+,寫出該微粒的電子式_____,如何檢驗某溶液中含該離子_____。
(3)元素Z在周期表中的位置_____,元素Z與元素T相比,非金屬性較強的是_____(用元素符號表示),下列表述中能證明這一事實的是_____(填序號)。
a.常溫下Z的單質和T的單質狀態不同
b.Z的氫化物比T的氫化物穩定
c.一定條件下,Z和T的單質都能與氫氧化鈉溶液反應
【答案】![]()
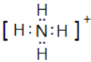 取少量試樣加入到試管中,加入 濃NaOH溶液并加熱,在試管口用濕潤的紅色石蕊試紙檢驗放出的氣體,試紙變為藍色,說明試樣中存在NH4+ 第三周期ⅦA族 Cl b
取少量試樣加入到試管中,加入 濃NaOH溶液并加熱,在試管口用濕潤的紅色石蕊試紙檢驗放出的氣體,試紙變為藍色,說明試樣中存在NH4+ 第三周期ⅦA族 Cl b
【解析】
T原子M層上有6個電子,T為S元素;X最外層電子數是次外層電子數的2倍,X為C元素;Y常溫下單質為雙原子分子,其氫化物水溶液呈堿性,Y為N元素;Z元素最高正價是+7價,Z為Cl元素;W的單質既能跟酸反應,又能跟強堿反應,都產生H2,W為Al元素,據此分析解答。
根據上述分析,T為S元素,X為C元素,Y為N元素,Z為Cl元素,W為Al元素。
(1)X為C元素,其同位素原子有![]() 、
、![]() ,其中
,其中![]() 具有放射性,常用于測定文物年代,故答案為:
具有放射性,常用于測定文物年代,故答案為:![]() ;
;
(2)元素N與氫元素形成一種離子NH4+,其電子式為: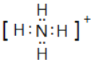 ;在含有銨根離子的溶液中加強堿,加熱,生成的氨氣用濕潤的紅色石蕊試紙檢驗,其操作為:取少量試樣加入到試管中,加入 濃NaOH溶液并加熱,在試管口用濕潤的紅色石蕊試紙檢驗放出的氣體,試紙變為藍色,說明試樣中存在NH4+,故答案為:
;在含有銨根離子的溶液中加強堿,加熱,生成的氨氣用濕潤的紅色石蕊試紙檢驗,其操作為:取少量試樣加入到試管中,加入 濃NaOH溶液并加熱,在試管口用濕潤的紅色石蕊試紙檢驗放出的氣體,試紙變為藍色,說明試樣中存在NH4+,故答案為: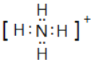 ;取少量試樣加入到試管中,加入 濃NaOH溶液并加熱,在試管口用濕潤的紅色石蕊試紙檢驗放出的氣體,試紙變為藍色,說明試樣中存在NH4+;
;取少量試樣加入到試管中,加入 濃NaOH溶液并加熱,在試管口用濕潤的紅色石蕊試紙檢驗放出的氣體,試紙變為藍色,說明試樣中存在NH4+;
(3)Z為Cl元素,位于第三周期第ⅦA族;S和Cl位于同周期,Cl元素非金屬性較強;a.單質的狀態與相應元素的非金屬性強弱之間不存在必然聯系,a錯誤;b.相應元素的非金屬性就越強,生成的氫化物的穩定性越強,故可以證明Cl元素的非金屬性比較強,b正確;c.單質能與NaOH溶液反應與相應元素的非金屬性強弱沒有必然聯系,c錯誤;故答案為:第三周期第ⅦA族;Cl;b。


科目:高中化學 來源: 題型:
【題目】中國政府承諾到2020年單位GDP二氧化碳排放比2005年下降40%~45%。CO2可轉化成有機物實現碳循環。在體積為1L的密閉容器中充入1mol CO2和3mol H2,一定條件下發生反應:![]() ,測得CO2和CH3OH(g)的濃度隨時間的變化如圖所示。
,測得CO2和CH3OH(g)的濃度隨時間的變化如圖所示。

(1)3~9min內,v(H2)=_________mol·L-1·min-1。
(2)能說明上述反應達到平衡狀態的是________(填序號)。
A.反應中CO2與CH3OH的物質的量濃度之比為l:1(即圖中交點)
B.混合氣體的密度不隨時間的變化而變化
C.單位時間內消耗3mol H2,同時生成1mol CO2
D. CO2的體積分數在混合氣體中保持不變
(3)平衡時CO2的轉化率為________
(4)平衡時混合氣體中CH3OH(g)的體積分數為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求完成下列填空:
(1)![]() H、
H、![]() H、
H、![]() H互為__;O2、O3互為__。
H互為__;O2、O3互為__。
(2)在下列固體中:a.CaCl2 b.KOH c.He d.H2SO4 e.NH4Cl f.金剛石
①其中不含化學鍵的物質是__。
②既含有離子鍵又含有共價鍵的物質是__(填序號)。
(3)如圖是幾種常見的電池裝置。請回答:

①電池Ⅰ中負極反應式是__,溶液中H+向__(填“負”或“正”)極移動,若1mol電子流過導線,則產生氫氣的物質的量是__mol。
②電池Ⅱ屬于__電池(填“一次”或“二次”).
③電池Ⅲ是氫氧燃料電池,寫出負極的電極反應式是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組進行下列實驗:
①將0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1 NaOH溶液等體積混合得到濁液
②取少量①中濁液,滴加0.1 mol·L-1 FeCl3溶液,出現紅褐色沉淀
③將①中濁液過濾,取少量白色沉淀,滴加0.1 mol·L-1 FeCl3溶液,白色沉淀變為紅褐色沉淀
④另取少量白色沉淀,滴加飽和NH4Cl溶液,沉淀溶解
下列說法中不正確的是( )
A. 將①中所得濁液過濾,所得濾液中含少量Mg2+
B. ①中濁液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
C. 實驗②和③均能說明Fe(OH)3比Mg(OH)2難溶
D. NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學家正在研究尿素動力燃料電池,尿液也能發電。用這種電池直接去除城市廢水中的尿素,既能產生凈化的水,又能發電,尿素燃料電池結構如圖所示,下列有關描述正確的是( )

A. 電池工作時H+移向負極
B. 該電池用的電解質溶液是KOH溶液
C. 甲電極反應式:CO(NH2)2+H2O-6e-=CO2+N2+6H+
D. 電池工作時,理論上每凈化1 mol CO(NH2)2,消耗33.6 L O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化亞銅是一種重要的化工產品,常用作有機合成催化劑,還可用于顏料、防腐等工業,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于濃鹽酸和氨水,在潮濕空氣中易水解氧化成綠色的堿式氯化銅[Cu2(OH)3Cl]。以海綿銅(主要成分是Cu和少量CuO)為原料,采用硝酸銨氧化分解技術生產CuCl的工藝過程如下:

(1)寫出溶解過程中發生的氧化還原反應的離子方程式:_________
(2)還原過程中發生的主要反應的離子方程式:_________。
(3)析出的CuCl晶體水洗后要立即用無水乙醇洗滌,在真空干燥機內于70℃干燥2h,冷卻密封包裝。70℃真空干燥、密封包裝的原因是__________。
(4)寫出氯化亞銅在空氣中被氧化的化學方程式________
(5)如圖是各反應物在最佳配比條件下,反應溫度對CuCl產率影響.由圖可知,溶液溫度控制在60℃時,CuCl產率能達到94%,當溫度高于65℃時,CuCl產率會下降,其原因可能是___。

(6)以碳棒為電極電解CuCl2溶液也可得到CuCl,寫出電解時陰極上發生的電極反應式:____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,將濃度均為0.1mol/L,體積分別為Va和Vb的HA溶液與BOH溶液按不同體積比混合,保持Va+Vb=100mL,Va、Vb與混合液pH的關系如圖所示,下列說法正確的是

A. Ka=1×10-6
B. b點時,c(B+)=c(A-)
C. c點時,![]() 隨溫度升高而增大
隨溫度升高而增大
D. a→c過程中水的電離程度始終增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.下面是甲、乙、丙三位同學制取乙酸乙酯的過程,請你參與完成相關實驗問題討論。
(實驗目的)制取乙酸乙酯
(實驗原理)甲、乙、丙三位同學均采取乙醇、乙酸與濃硫酸混合共熱的方法制取乙酸乙酯。
(裝置設計)甲、乙、丙三位同學分別設計了下列三套實驗裝置:

根據分析回答:(1)三位同學設計的裝置中最不合理的是____(選填“甲”或“乙”或“丙”),原因是_________________。
(實驗步驟)
a.按所選擇的裝置組裝儀器,在試管①中先加入3mL乙醇,并在搖動下緩緩加入2mL濃硫酸充分搖勻,冷卻后再加入2mL冰醋酸;
b.將試管固定在鐵架臺上;
c.在試管②中加入適量的飽和Na2CO3溶液;
d.用酒精燈對試管①加熱;
e.當觀察到試管②中有明顯現象時停止實驗。
(2)試管①中加入濃硫酸的作用是______________________________
(3)該實驗中長導管的作用是___________________。
(4)試管②中飽和Na2CO3溶液的作用是_______________;可否用NaOH溶液代替Na2CO3溶液?_____(填“是”或“否”),理由是用化學方程式回答_______________。
(5)寫出試管①中乙醇工業制取的化學方程式________________________________;
II.實驗室制備硝基苯的主要步驟如下:
a、配制一定比例的濃H2SO4與濃HNO3的混合酸,加入反應器中;
b、向室溫下的混合酸中逐滴加入一定量的苯,充分振蕩,混合均勻;
c、在55~60℃下發生反應,直至反應結束;
d、除去混合酸后,粗產品依次用蒸餾水和5%NaOH溶液洗滌,最后再用蒸餾水洗滌;
e、將用無水CaCl2干燥后的粗硝基苯進行蒸餾,得到純凈硝基苯。請填寫下列空白:
①制備硝基苯的反應類型是________________。
②配制一定比例的濃H2SO4與濃HNO3的混合酸時,操作的注意事項是:_____。
③步驟d中洗滌、分離粗硝基苯應使用的儀器是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用廢鐵屑制備磁性膠體粒子,制取過程如下:

下列說法不正確的是
A. 用Na2CO3溶液浸泡是為了除去廢鐵屑表面的油污
B. 通入N2是防止空氣中的O2氧化二價鐵元素
C. 加適量的H2O2是為了將部分Fe2+氧化為Fe3+,涉及反應:H2O2+2Fe2++2H+=2Fe3++2 H2O
D. 溶液A中Fe2+和Fe3+的濃度比為2:1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com