
| A. | 若n(Cu2+):n(IO3-)=1:1,則每生成1molCuI轉移6mol電子 | |
| B. | 若n(Cu2+):n(IO3-)=1:2,則每生成1molCuI轉移12mol電子 | |
| C. | CuI既是氧化產物又是還原產物 | |
| D. | HI只有還原性沒有氧化性 |
分析 Cu2++IO3-+I-+H+=CuI↓+I2+H2O中,Cu元素的化合價由+2價降低為+1價,I元素的化合價由+5價降低為0,I元素的化合價由-1價升高為0,根據轉移電子數等于化合價變化×對應的物質的量即可,據此解答.
解答 解:A.若n(Cu2+):n(IO3-)=1:1,則每生成1molCuI即有1molCu2+和1molIO3-參與反應,所以轉移1+5=6mol電子,故A正確;
B.若n(Cu2+):n(IO3-)=1:2,則每生成1molCuI即有1molCu2+和2molIO3-參與反應,所以轉移1+10=11mol電子,故B錯誤;
C.CuI為生成物,Cu元素得到電子后的生成物,僅為還原產物,故C錯誤;
D.HI中H元素化合價可降低,I元素可升高,所以HI既有還原性又有氧化性,故D錯誤;
故選A.
點評 本題考查氧化還原反應,為高頻考點,把握反應中元素的化合價變化為解答的關鍵,側重氧化還原反應基本概念及轉移電子的考查,注意從化合價角度分析,題目難度不大.


 名師點撥卷系列答案
名師點撥卷系列答案 英才計劃期末調研系列答案
英才計劃期末調研系列答案科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗目的 | 實驗方案 |
| A | 檢驗食鹽中是否添加KIO3 | 取食鹽試樣,溶于KI溶液,加入淀粉溶液,觀察溶液是否變藍 |
| B | 驗證硝酸是揮發性酸 | 用兩根玻璃棒分別蘸取濃硝酸和濃氨水,然后靠近,觀察是否有白煙產生 |
| C | 驗證Br2氧化性強于Fe3+ | 取少許FeCl3晶體溶于稀鹽酸,加入KSCN觀察溶液是否變紅,滴入溴水后再觀察是否變紅 |
| D | 驗證氯酸鉀中含有氯元素 | 取少量氯酸鉀加入MnO2充分加熱,殘留物溶于水,取上層清液,滴入硝酸酸化的AgNO3溶液,觀察是否有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶質的質量分數為w=$\frac{a}{Vρ-a}$×100% | |
| B. | 上述溶液中再加入V mL水后,所得溶液溶質的質量分數大于0.5w | |
| C. | 上述溶液中再加入相同質量的水后,所得溶液的物質的量濃度變為原來一半 | |
| D. | 溶質的物質的量濃度c=$\frac{1000a}{17V}$ mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 任何可逆反應都有一定的限度,且限度是可以改變的 | |
| B. | 對任何化學反應來說,反應速率越大,則現象越明顯 | |
| C. | 決定化學反應速率的主要因素是溫度、濃度、壓強 | |
| D. | 鐵與稀硫酸反應制氫氣時,改用98.3%的濃硫酸,對增大化學反應速率明顯有效 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應前酸、堿溶液的溫度要相同 | |
| B. | 環形玻璃棒攪拌能加快反應速率,減小實驗誤差 | |
| C. | 為了使反應均勻進行,可以向酸(堿)中分次加入堿(酸) | |
| D. | 為了使反應更完全,可以使酸或堿適當過量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 除去乙烷中的乙烯,將氣體通入酸性 KMnO4溶液 | |
| B. | 除去溴苯中的溴,加入 KI 溶液后分液 | |
| C. | 除去 CH2Cl2 中的 HCl,加水分液 | |
| D. | 除去硝基苯中的苯,加水分液 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
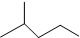 表示的分子式C6H14;名稱2-甲基戊烷.
表示的分子式C6H14;名稱2-甲基戊烷.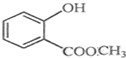 中含有的官能團的名稱為酚羥基、酯基.
中含有的官能團的名稱為酚羥基、酯基. .3-甲基-2-乙基-1-戊烯結構簡式為CH3CH(CH3)CH2C(CH2CH3)=CH2.
.3-甲基-2-乙基-1-戊烯結構簡式為CH3CH(CH3)CH2C(CH2CH3)=CH2.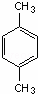 名稱為對二甲苯.
名稱為對二甲苯.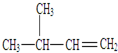 名稱為3-甲基-1-丁烯.
名稱為3-甲基-1-丁烯.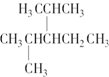 名稱為2,4-二甲基-3--乙基戊烷.
名稱為2,4-二甲基-3--乙基戊烷.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯化銅溶液中加入氫氧化鐵 | B. | 硝酸鋁溶液中加入氫氧化鈉 | ||
| C. | 氫氧化鉀溶液中加入硫化銅 | D. | 碳酸鈉中加入氫氧化鉀 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com