
| 產品標準 | GB5461 |
| 產品等級 | 一級 |
| 配 料 | 食鹽、碘酸鉀、抗結劑 |
| 碘含量(以I計) | 20~50mg/kg |
| 分裝時期 | |
| 分裝企業 |
分析 (1)①Na2SO3稀溶液與I2反應,Na2SO3被氧化為硫酸鈉,I2被還原為I-,結合反應的電荷守恒和原子守恒配平;
溶液呈藍色,隨反應I2+2S2O32-=2I-+S4O62-進行,溶液中沒有碘,溶液由藍色為無色;
②Na2SO3稀溶液與碘的四氯化碳溶液不互溶,分層,要使Na2SO3與碘反應,應充分振蕩使其接觸;
(2)根據題意,Na2S2O3的物質的量為2.0×10-3mol•L-1×10.0L×10-3mol=2.0×10-5mol,根據反應I2+2S2O32-=2I-+S4O62-可知,的物質的量為1.0×10-5mol,再根據5I-+6H++IO3-=3I2+3H2O,可知食鹽中碘酸鉀的物質的量為$\frac{1}{3}$×10-5mol,據此計算精制鹽的碘含量;
(3)將I2溶于KI溶液,在低溫條件下,可制得KI3•H2O,在空氣中容易被氧化,且加熱碘易升華,據此答題;
(4)檢驗加碘鹽中的Fe2+,可以根據亞鐵離子遇KSCN溶液不呈色,被氧化成鐵離子后呈血紅色,據此答題.
解答 解:(1)①Na2SO3稀溶液與I2反應,Na2SO3被氧化為硫酸鈉,I2被還原為I-,反應的離子方程式是:I2+SO32-+H2O=2I-+SO42-+2H+,
故答案為:I2+SO32-+H2O=2I-+SO42-+2H+;
②Na2SO3稀溶液與碘的四氯化碳溶液不互溶,分層,要使Na2SO3與碘反應,應充分振蕩使其接觸.所以在步驟b后,增加操作:將分液漏斗充分振蕩后靜置,
故答案為:在步驟b后,增加操作:將分液漏斗充分振蕩后靜置;
(2)根據題意,Na2S2O3的物質的量為2.0×10-3mol•L-1×10.0L×10-3mol=2.0×10-5mol,根據反應I2+2S2O32-=2I-+S4O62-可知,的物質的量為1.0×10-5mol,再根據5I-+6H++IO3-=3I2+3H2O,可知食鹽中碘酸鉀的物質的量為$\frac{1}{3}$×10-5mol,所以精制鹽的碘含量為$\frac{\frac{1}{3}×10{\;}^{-5}mol×127g/mol}{\frac{100}{1000}wg}$=$\frac{12700}{3w}$mg/kg,
故答案為:$\frac{12700}{3w}$;
(3)將I2溶于KI溶液,在低溫條件下,可制得KI3•H2O,在空氣中容易被氧化,且加熱碘易升華,所以不能用KI3•H2O作為食鹽加碘劑,
故答案為:否;KI3•H2O,在空氣中容易被氧化,且加熱碘易升華;
(4)檢驗加碘鹽中的Fe2+,可以根據亞鐵離子遇KSCN溶液不呈色,被氧化成鐵離子后呈血紅色,所以操作為在少是食鹽樣品溶液中滴加KSCN溶液,溶液呈無色,再加入氯水或雙氧水,溶液呈血紅色,則樣品中有Fe2+,
故答案為:在少是食鹽樣品溶液中滴加KSCN溶液,溶液呈無色,再加入氯水或雙氧水,溶液呈血紅色,則樣品中有Fe2+.
點評 本題考查了氧化還原反應方程式的配平及有關計算,需要注意的是求食鹽中碘的含量不是碘酸鉀的含量,中等難度.


科目:高中化學 來源: 題型:選擇題
| A. | 利用外接直流電源保護鐵質建筑物,屬于電化學中犧牲陽極的陰極保護法 | |
| B. | 碰撞理論和過渡態理論是常用的反應速率理論,其中過渡態理論可解釋溫度、催化劑等對反應速率的影響 | |
| C. | 人們通常用標準燃燒熱或熱值來衡量燃料燃燒放出熱量的大小,其中標準燃燒熱是指101kPa下,1g物質完全燃燒的反應熱 | |
| D. | 改變影響化學平衡的一個因素,平衡將向著能夠減弱這種改變的方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵與稀硫酸反應 | B. | 灼熱的碳與CO2的反應 | ||
| C. | Ba(OH)2•8H2O與NH4Cl的反應 | D. | 乙烷在氧氣中的燃燒反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ③⑤ | B. | ③④⑤ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| W | X | Y | ||
| Z | M | Q |
| A. | W、X、Y中最簡單氫化物穩定性最弱的是Y | |
| B. | Q元素形成的單質微粒間作用力除了分子間作用力還含有共價鍵 | |
| C. | M元素氧化物對應水化物的酸性一定強于Z | |
| D. | 電解飽和的NaM溶液可以制取H2和NaMX |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3-CH=CH2和  | |
| B. | CH3CH2CHBrCH2Br 和CH3CHBrCH2Br | |
| C. | 苯與溴苯 | |
| D. | CH2=CH-CH=CH2和CH3-CH2-CH2-C≡CH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數為8、中子數為10的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧原子的結構示意圖: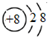 | |
| C. | 水分子的電子式: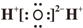 | |
| D. | 乙酸甲酯的結構簡式HCOOC2H5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com