
【題目】工業上可用![]() 與
與![]() 合成亞硝酰氯
合成亞硝酰氯![]() ,可以用于有機合成。回答下列問題:
,可以用于有機合成。回答下列問題:
(1)一定條件下,氮氧化物與懸浮在大氣中的海鹽粒子相互作用時會生成亞硝酰氯,涉及有關反應的熱化學方程式如下:
①![]()
②![]()
③![]()
則![]()
![]() __________(用
__________(用![]() 、
、![]() 表示)。
表示)。
(2)![]() 時,在一密閉容器中發生反應:
時,在一密閉容器中發生反應:![]() ,其正反應速率表達式
,其正反應速率表達式![]() 。測得正反應速率和對應濃度的數據如表:
。測得正反應速率和對應濃度的數據如表:
序號 |
|
|
① |
|
|
② |
|
|
③ |
|
|
則![]() __________達到平衡后,若減小壓強,則混合氣體的平均相對分子質量將__________(選填“增大”、“減小”或“不變”)。
__________達到平衡后,若減小壓強,則混合氣體的平均相對分子質量將__________(選填“增大”、“減小”或“不變”)。
(3)![]() 時,向體積為
時,向體積為![]() 且帶氣壓計的恒容密閉容器中通入
且帶氣壓計的恒容密閉容器中通入![]() 和
和![]() 發生反應:
發生反應:
![]() 。已知:反應起始和平衡時溫度相同。
。已知:反應起始和平衡時溫度相同。

①測得反應過程中壓強![]() 隨時間
隨時間![]() 的變化如圖1曲線
的變化如圖1曲線![]() 所示,則
所示,則![]() __________(選填“>”、“<”或“不確定”)0;若其他條件相同,僅改變某一條件時,測得壓強
__________(選填“>”、“<”或“不確定”)0;若其他條件相同,僅改變某一條件時,測得壓強![]() 隨時間
隨時間![]() 的變化如圖1曲線
的變化如圖1曲線![]() 所示,則改變的條件是_________。
所示,則改變的條件是_________。
②圖2是兩位同學描繪的上述反應平衡常數的對數值![]() 與溫度的變化關系圖象,其中正確的曲線是______(選填“甲”或“乙”);
與溫度的變化關系圖象,其中正確的曲線是______(選填“甲”或“乙”);![]() 的值為______。
的值為______。
【答案】![]() (ΔH2+ΔH3) 1.2 減小 < 加入催化劑 乙 3
(ΔH2+ΔH3) 1.2 減小 < 加入催化劑 乙 3
【解析】
(1)根據蓋斯定律可知,反應③=2×反應①-反應②;
(2)根據 ![]() ,
,![]() ,
,![]() ,解得
,解得![]() ,
,![]() ;減小壓強,平衡正向移動,則混合氣體的平均相對分子質量將減小;
;減小壓強,平衡正向移動,則混合氣體的平均相對分子質量將減小;
(3)①分析題圖1曲線a知反應過程中壓強先增大后減小至不變,壓強先增大是因為正反應放熱,隨著反應的進行,反應物濃度減小,壓強又減小至不變;曲線b與曲線a相比,反應速率加快,平衡狀態不變,故改變的條件是加入催化劑;
②該反應為放熱反應,則升溫平衡逆向移動,平衡常數減小,lgK減小,故曲線乙正確,設反應達到平衡時,![]() 轉化了x mol·L1,由三段式法計算。
轉化了x mol·L1,由三段式法計算。
(1)根據蓋斯定律可知,反應③=2×反應①-反應②,則![]() ,故
,故![]() ,故答案為:
,故答案為:![]() ;
;
(2)根據 ![]() ,
,![]() ,
,![]() ,解得
,解得![]() ,
,![]() ;帶入
;帶入![]() 得
得![]() ;減小壓強,平衡正向移動,則混合氣體的平均相對分子質量將減小;故答案為:1.2;減小;
;減小壓強,平衡正向移動,則混合氣體的平均相對分子質量將減小;故答案為:1.2;減小;
(3)①分析題圖1曲線a知反應過程中壓強先增大后減小至不變,壓強先增大是因為正反應放熱,隨著反應的進行,反應物濃度減小,壓強又減小至不變,故![]() ;曲線b與曲線a相比,反應速率加快,平衡狀態不變,故改變的條件是加入催化劑,故答案為:<;加入催化劑;
;曲線b與曲線a相比,反應速率加快,平衡狀態不變,故改變的條件是加入催化劑,故答案為:<;加入催化劑;
②該反應為放熱反應,則升溫平衡逆向移動,平衡常數減小,lgK減小,故曲線乙正確,設反應達到平衡時,![]() 轉化了x mol·L1,由三段式法計算:
轉化了x mol·L1,由三段式法計算: ,根據反應起始和平衡時溫度相同,且反應在恒容容器中進行,則有
,根據反應起始和平衡時溫度相同,且反應在恒容容器中進行,則有![]() ,解得x=0.001,故25℃時平衡常數K=
,解得x=0.001,故25℃時平衡常數K= ,1gK=3,故答案為:乙;3。
,1gK=3,故答案為:乙;3。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】用NA表示阿伏伽德羅常數的數值,下列敘述正確的是
A. 78g苯中含有的碳碳雙鍵的數目為3NA
B. 16gCu2S和CuO組成的混合物中含有的陽離子數為0.2NA
C. 將1mol H2與 1 mol I2充入一密閉容器中充分反應后,轉移的電子書為2NA
D. 1 mol Fe 與足量的濃硫酸共熱反應,生成SO2的分子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】糧食倉儲常用磷化鋁(AlP)熏蒸殺蟲,AlP遇水即產生強還原性的PH3氣體。國家標準規定糧食中磷化物(以PH3計)的殘留量不超過0.05mg·kg-1為合格。某小組同學用如圖所示實驗裝置和原理測定某糧食樣品中磷化物的殘留量。C中加入100g原糧,E中加入20.00mL 2.50×10-4mol·L-1 KMnO4溶液(H2SO4酸化),向C中加入足量水,充分反應后,用亞硫酸鈉標準溶液滴定E中的溶液。
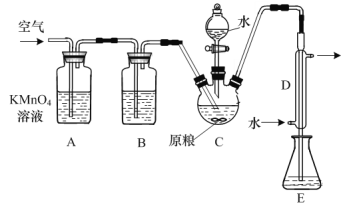
(1)反應后繼續通入空氣的作用是_______。
(2)裝置B中盛裝焦性沒食子酸的堿性溶液,其作用是吸收空氣中的_______(填化學式)。
(3)裝置E中PH3被氧化成磷酸,MnO![]() 被還原為Mn2+,則PH3和MnO
被還原為Mn2+,則PH3和MnO![]() 反應的物質的量之比為_______。
反應的物質的量之比為_______。
(4)收集裝置E中的吸收液,加水稀釋至250mL,移取其中的25.00mL于錐形瓶中,用6.0×10-5mol·L-1的Na2SO3標準溶液滴定,消耗Na2SO3標準溶液20.00 mL,反應原理是:SO![]() +MnO
+MnO![]() +H+= SO
+H+= SO![]() +Mn2++H2O(未配平)。通過計算判斷該樣品是否合格(寫出計算過程)_____。
+Mn2++H2O(未配平)。通過計算判斷該樣品是否合格(寫出計算過程)_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】普通水泥在固化過程中自由水分子減少并產生Ca(OH)2,溶液呈堿性。根據這一物理化學特點,科學家發明了電動勢法測水泥初凝時間。此方法的原理如圖所示,反應的總方程式為:2Cu+Ag2O=Cu2O+2Ag,下列有關說法正確的

A.Cu為正極,Ag2O為負極
B.電池工作時,OH—向正極移動
C.正極的電極反應為:2Cu+2OH——2e—=Cu2O+H2O
D.外電路中每通過2mol電子,正極質量減少16g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源是國民經濟發展的重要基礎,我國目前使用的能源主要是化石燃料。
(1)在25℃、101kPa時,8gCH4完全燃燒生成液態水時放出的熱量是445.15kJ,則CH4燃燒的熱化學方程式______________________________________________________。
(2)已知:C(s)+O2(g) = CO2(g) △H=-437.3kJ·mol -1
H2(g)+1/2O2(g) = H2O(g) △H=-285.8kJ·mol-1
CO(g)+1/2O2(g) = CO2(g) △H=-283.0kJ·mol-1
則煤氣化反應C(s)+H2O(g) = CO(g)+H2(g)的焓變△H=___________ kJ·mol-1。
(3)人們利用原電池原理制作了多種電池,以滿足日常生活、生產和科學技術等方面的需要。請根據題中提供的信息,回答下列問題。
①鉛蓄電池在放電時的電池反應為Pb+PbO2+2H2SO4==2PbSO4+2H2O,則其正極上的電極反應為________________________________________________________。
②FeCl3溶液腐蝕印刷電路銅板時發生反應:2FeCl3+Cu==2FeCl2+ CuCl2。若將此反應設計成原電池,則負極所用的電極材料為_____;電極反應式:_________________。
③已知甲醇燃料電池的工作原理如下圖所示。該電池工作時,b口通入的物質為_____,該電池正極上的電極反應式為___________________;當6.4g甲醇(CH3OH)完全反應生成CO2時,有___ mol電子發生轉移。若將電池的電解質溶液換為KOH溶液,則負極的電極方程式為______________________。
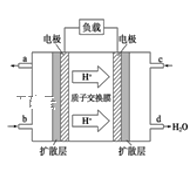
(4)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,電解該混合溶液可獲得較濃的硝酸。寫出電解時陽極的電極反應式為_____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某工廠對工業生產鈦白粉產生的廢液進行綜合利用,廢液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3,可用于生產顏料鐵紅和補血劑乳酸亞鐵。其生產工藝流程如圖:
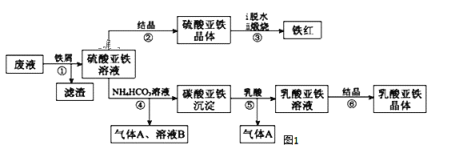
已知:乳酸可以和碳酸根生成二氧化碳氣體。請回答:
(1)步驟④需控制反應溫度低于35℃,其目的是___。
(2)步驟④反應的離子方程式是___。
(3)已知:FeCO3(s) Fe2+(aq)+CO32-(aq),試用平衡移動原理解釋步驟⑤生成乳酸亞鐵的原因___。
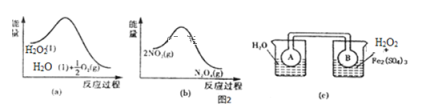
(4)Fe3+對H2O2的分解具有催化作用。利用如圖(a)和(b)中的信息,按圖(c)裝置(連通的A、B瓶中已充有NO2氣體)進行實驗。可觀察到B瓶中氣體顏色比A瓶中的___(填“深”或“淺”),其原因是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下圖表示的一些物質或概念間的從屬關系中正確的是
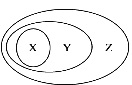
X | Y | Z | |
A | 水 | 單質 | 純凈物 |
B | 非金屬氧化物 | 酸性氧化物 | 氧化物 |
C | 電解質 | 化合物 | 純凈物 |
D | 化合反應 | 氧化還原反應 | 化學反應 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,圖Ⅰ是恒壓密閉容器,圖Ⅱ是恒容密閉容器.當其它條件相同時,在Ⅰ、Ⅱ中分別加入2molX和2molY,開始時容器的體積均為VL,發生如下反應并達到平衡狀態(提示:物質X、Y的狀態均未知,物質Z的狀態為氣態):2X(?)+Y(?)aZ(g)此時Ⅰ中X、Y、Z的物質的量之比為1:3:2。下列判斷正確的是( )
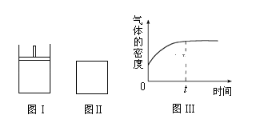
A.物質Z的化學計量數a=2
B.若Ⅱ中氣體的密度如圖Ⅲ所示,則X、Y中只有一種為氣態
C.若X、Y均為氣態,則在平衡時X的轉化率:Ⅰ<Ⅱ
D.若X為固態、Y為氣態,則Ⅰ、Ⅱ中從開始到平衡所需的時間:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.22.4L CO2與足量Na2O2反應轉移的電子數為NA
B.1mol·L-1的NaOH溶液中含Na+數目為NA
C.78gNa2O2晶體中含有的陰離子數目為2NA
D.a g CO和H2的混合氣體充分燃燒的產物與足量的Na2O2充分反應后,固體質量增加ag
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com