
| A. | 等物質的量的硫蒸氣和硫固體分別完全燃燒,后者放出熱量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若將含0.5 mol H2SO4的濃硫酸與含1 mol NaOH的溶液混合,放出的熱量大于57.3 kJ | |
| C. | 由C(石墨)═C(金剛石)△H=1.90 kJ•mol-1可知,金剛石比石墨穩定 | |
| D. | 在100 kPa時,2 g H2完全燃燒生成液態水,放出285.8 kJ熱量,則H2燃燒的熱化學方程式為2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
分析 A、硫蒸氣變化為硫固體為放熱過程;
B.濃硫酸溶于水放熱;
C.物質的能量越低越穩定;
D.2gH2完全燃燒生成液態水,放出285.8kJ熱量,則1molH2完全燃燒生成液態水,放出285.8kJ熱量.
解答 解:A、硫蒸氣變化為硫固體為放熱過程,則等量的硫蒸氣和硫固體在氧氣中分別完全燃燒,放出熱量硫蒸氣多,即前者放出熱量多,故A錯誤;
B.在稀溶液中H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,說明該中和反應中生成1mol液態水放出57.3kJ熱量;由于濃硫酸溶于水放熱,則將含0.5molH2SO4的濃硫酸與含1mol NaOH的溶液混合,放出的熱量大于57.3 kJ,故B正確;
C、由C(石墨)=C(金剛石);△H=+1.90 kJ/mol可知金剛石的能量比石墨的能量高,所以石墨比金剛石穩定,故C錯誤;
D、2gH2完全燃燒生成液態水,放出285.8kJ熱量,則1molH2完全燃燒生成液態水,放出285.8kJ熱量,所以氫氣燃燒的熱化學方程式為H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol,故D錯誤.
故選B.
點評 本題考查了化學反應中的能量變化、中和熱概念理解、反應自發性的判斷等,屬于基礎知識的考查,題目難度不大.


 全能練考卷系列答案
全能練考卷系列答案 一課一練課時達標系列答案
一課一練課時達標系列答案科目:高中化學 來源: 題型:填空題
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
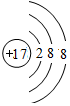 ,離子半徑最大的是S 2-.
,離子半徑最大的是S 2-.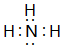 ;⑤的一種氧化物呈淡黃色,其含有的化學鍵類型有離子鍵和共價鍵,電子式為
;⑤的一種氧化物呈淡黃色,其含有的化學鍵類型有離子鍵和共價鍵,電子式為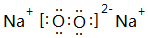 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 容器 | 溫度/k | 物質的起始濃度/mol•L-1 | 物質的平衡濃度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 該方應的正反應吸熱 | |
| B. | 達到平衡時,容器Ⅰ中反應物轉化率比容器Ⅱ中的大 | |
| C. | 達到平衡時,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的兩倍 | |
| D. | 達到平衡時,容器Ⅲ中的反應速率比容器Ⅰ中的大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
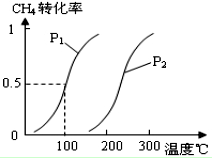 甲醇被稱為2l世紀的新型燃料,工業上通過下列反應①和②,用CH4和H2O為原料來制備甲醇.
甲醇被稱為2l世紀的新型燃料,工業上通過下列反應①和②,用CH4和H2O為原料來制備甲醇.| 實驗編號 | T(℃) | n (CO)/n(H2) | P(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
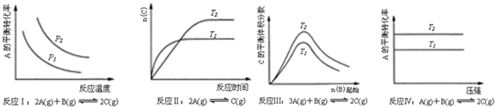
| A. | 反應Ⅰ:△H>0,P2>P1 | B. | 反應Ⅱ:△H<0,T1>T2 | ||
| C. | 反應Ⅲ:△H<0,T2>T1 | D. | 反應Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
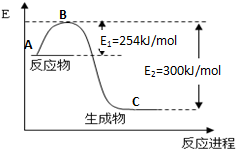 到目前為止,由化學能轉變的熱能或電能仍然是人類使用最廣泛的能源.
到目前為止,由化學能轉變的熱能或電能仍然是人類使用最廣泛的能源.| 化學鍵 | H-H | N≡N |
| 鍵能(kJ/mol) | 435 | 943 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若a=b,則容器中可能使用了催化劑或恒溫恒容下充入惰性氣體 | |
| B. | 在該溫度下,保持容積固定不變,向容器內補充了B氣體,則a<b | |
| C. | 若其他條件不變,升高溫度,則a<b | |
| D. | 若保持溫度、壓強不變,充入惰性氣體,則a>b |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 改變壓強,平衡不發生移動,反應放出的熱量不變 | |
| B. | 加入催化劑,改變了反應的途徑,反應的△H也隨之改變 | |
| C. | 若在原電池中進行,反應放出的熱量不變 | |
| D. | 升高溫度,反應速率加快,反應放出的熱量不變 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com