
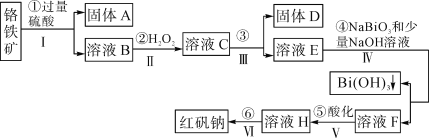
【題目】以鉻鐵礦(主要成分為FeO和Cr2O3,含有Al2O3、SiO2等雜質)為主要原料生產化工原料紅礬鈉(主要成分Na2Cr2O7·2H2O),其主要工藝流程如圖:
查閱資料得知:
ⅰ.常溫下,NaBiO3不溶于水,有強氧化性,在堿性條件下,能將Cr3+轉化為CrO42-。
ⅱ.
金屬離子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
開始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列問題:
(1)反應之前先將礦石粉碎的目的是___。
(2)步驟③加的試劑為___,目的是將溶液pH要調到5使Fe3+、Al3+均完全轉化為Fe(OH)3和Al(OH)3沉淀而除去。
(3)寫出反應④的離子反應方程式___。
(4)⑤中酸化是使CrO42-轉化為Cr2O72-,寫出該反應的離子方程___。
(5)將溶液H經過蒸發濃縮,冷卻結晶,過濾,洗滌,干燥即得紅礬鈉粗晶體,精制紅礬鈉則對粗晶體需要采用的操作是___(填操作名稱)。
【答案】增大反應物的接觸面積,加快反應速率,提高鉻鐵礦的浸取率 氫氧化鈉溶液(或NaOH溶液) 3NaBiO3+2Cr3++7OH-+H2O=3Bi(OH)3+2CrO42-+3Na+ 2CrO42-+2H+![]() Cr2O72-+H2O 重結晶
Cr2O72-+H2O 重結晶
【解析】
鉻鐵礦(主要成分為FeO和Cr2O3,含有Al2O3、SiO2等雜質),加入過量稀硫酸,固體A為SiO2,溶液B中含有Cr3+、Al3+、Fe2+,在B中加入過氧化氫,可生成Fe3+,調節溶液pH可除去Fe3+、Al3+,生成氫氧化鐵、氫氧化鋁沉淀,即固體D,溶液E含有Cr3+,在溶液E中加入NaBiO3和NaOH,發生氧化還原反應,固體G為Bi(OH)3,溶液F含有Na2CrO4,酸化可得Na2Cr2O7,溶液經蒸發濃縮、冷卻結晶可得Na2Cr2O72H2O,以此解答該題。
(1)為了增大反應物的接觸面積,加快反應速率,提高鉻鐵礦的浸取率,反應之前可先將礦石粉碎;
(2)根據表格數據分析,步驟③加的試劑為氫氧化鈉溶液或NaOH溶液;此時溶液pH要調到5的目的使Fe3+、Al3+均完全轉化為Fe(OH)3和Al(OH)3沉淀而除去,而鉻離子不沉淀,
故答案為:氫氧化鈉溶液(或NaOH溶液);
(3)在溶液E中加入NaBiO3和NaOH發生氧化還原反應,固體G為Bi(OH)3,反應的離子方程式為3NaBiO3+2Cr3++7OH-+H2O=3Bi(OH)3+2CrO42-+3Na+;
(4)酸化使CrO42-轉化為Cr2O72-,反應的離子方程式為2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(5)將溶液H經過蒸發濃縮,冷卻結晶,過濾,洗滌,干燥即得紅礬鈉粗晶體,此操作為重結晶。


科目:高中化學 來源: 題型:
【題目】標準狀況下VL氨氣溶解在1L水中(水的密度近似為1g/mL),所得溶液的密度為ρg/mL,質量分數為ω,物質濃度為c mol/L,則下列關系中不正確的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CH4-CO2催化重整不僅可以得到合成氣(CO和H2),還對溫室氣體的減排具有重要意義。回答下列問題:
(1)CH4-CO2催化重整反應為:CH4(g)+ CO2(g)=2CO(g)+2H2(g) △H=+247kJ/mol;
①有利于提高CH4平衡轉化率的條件是____
A. 高溫低壓 B.低溫高壓 C.高溫高壓 D.低溫低壓
②某溫度下,在體積為2 L的容器中加入2 mol CH4、1 mol CO2以及催化劑進行重整反應,達到平衡時CO2的轉化率是50%,其平衡常數為_______mol2·L2。
(2)反應中催化劑活性會因積碳反應而降低,同時存在的消碳反應則使積碳量減少。相關數據如下表:
積碳反應CH4(g)= C(s)+2H2(g) | 消碳反應CO2(g)+ C(s)= 2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/(kJ·mol1) | 催化劑X | 33 | 91 |
催化劑Y | 43 | 72 | |
①由上表判斷,催化劑X____Y(填“優于”或“劣于”),理由是_________________。在反應進料氣組成、壓強及反應時間相同的情況下,某催化劑表面的積碳量隨溫度的變化關系如圖所示。升高溫度時,下列關于積碳反應、消碳反應的平衡常數(K)和速率(v)的敘述正確的是________
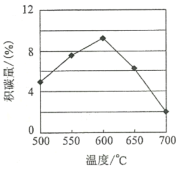
A.K積、K消均增加
B.v積減小,v消增加
C.K積減小,K消增加
D.v消增加的倍數比v積增加的倍數‘
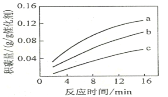
②在一定溫度下,測得某催化劑上沉積碳的生成速率方v=k·p(CH4)·![]() (k為速率常數)。在p(CH4)一定時,不同p(CO2)下積碳量隨時間的變化趨勢如圖所示,則pa(CO2)、pb(CO2)、pc(CO2)從大到小的順序為________________。
(k為速率常數)。在p(CH4)一定時,不同p(CO2)下積碳量隨時間的變化趨勢如圖所示,則pa(CO2)、pb(CO2)、pc(CO2)從大到小的順序為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨是人類科學技術發展史上的一項重大突破,研究表明液氨是一種良好的儲氫物質。
(1)氨氣分解反應的熱化學方程式如下:2NH3(g)![]() N2(g)+3H2(g) △H。若:N
N2(g)+3H2(g) △H。若:N![]() N鍵、H—H鍵和N—H鍵的鍵能值分別記作a、b和c(單位:kJmol-1)則上述反應的△H=______________(用含a、b、c的代數式表示)kJmol-1。
N鍵、H—H鍵和N—H鍵的鍵能值分別記作a、b和c(單位:kJmol-1)則上述反應的△H=______________(用含a、b、c的代數式表示)kJmol-1。
(2)研究表明金屬催化劑可加速氨氣的分解。某溫度下,用等質量的不同金屬分別催化等濃度的氨氣,測得氨氣分解生成氫氣的初始速率(單位:mmolmin-1)與催化劑的對應關系如表所示。
催化劑 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①在不同催化劑的催化作用下,氨氣分解反應的活化能最大的是______________(填寫催化劑的化學式)。
②溫度為T時,在恒容的密閉容器中加入2molNH3,此時壓強為po,用Ru催化氨氣分解,若平衡時氨氣的轉化率為50%,則該溫度下反應2NH3(g)![]() N2(g)+3H2(g)的化學平衡常數Kp=______________。(用平衡分壓代替平衡濃度計算,氣體分壓p分=氣體總壓P總×體積分數)
N2(g)+3H2(g)的化學平衡常數Kp=______________。(用平衡分壓代替平衡濃度計算,氣體分壓p分=氣體總壓P總×體積分數)
(3)關于合成氨工藝的理解,下列說法不正確的是______________(填字母)。
A.合成氨工業常采用的反應溫度為500℃左右,主要是為了節約能源
B.使用初始反應速率更快的催化劑Ru,不能提高平衡時NH3的產率
C.合成氨工業采用的壓強為10MPa~30MPa,是因為常壓下N2和H2的轉化率不高
(4)在1L1molL-1鹽酸中緩緩通入2mol氨氣,請在圖1中畫出溶液中水電離出的OH一濃度隨通入氨氣的物質的量變化的趨勢圖。_____________
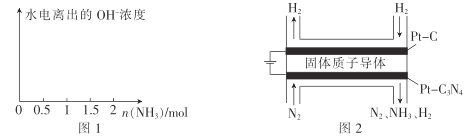
(5)電化學法合成氨:圖2是用低溫固體質子導體作電解質,用Pt—C3N4作陰極,催化電解H2(g)和N2(g)合成NH3的原理示意圖。
①Pt—C3N4電極上產生NH3的電極反應式為______________ 。
②實驗研究表明,當外加電壓超過一定值后,發現陰極產物中氨氣的體積分數隨著電壓的增大而減小,分析其可能原因:______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】α—松油醇是生產香精的重要原料,合成路線如圖所示:
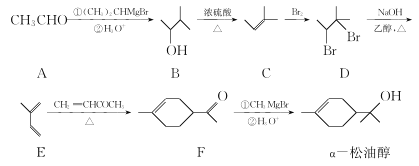
(1)α—松油醇中所含官能團的名稱為______________。
(2)C→D的反應類型為______________ 。
(3)E→F的反應中有副產物X(與F互為同分異構體)生成,寫出X的結構簡式:______________。
(4)α—松油醇的一種同分異構體同時滿足下列條件.寫出該同分異構體的結構簡式:______________。
①分子中所有化學鍵均飽和;
②分子中不同化學環境的氫原子數目比為1:4:4。
(5)已知:RBr![]() RMgBr(R表示經基)。寫出以溴乙烷和2—溴丙為烷原料制備
RMgBr(R表示經基)。寫出以溴乙烷和2—溴丙為烷原料制備![]() 的合成路線流程圖(無機試劑和有機溶劑任用,合成路線流程圖示例見本題題干)。______________
的合成路線流程圖(無機試劑和有機溶劑任用,合成路線流程圖示例見本題題干)。______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將1.92g銅粉與一定量的濃硝酸反應,當銅粉完全作用時收集到氣體1.12L(標準狀況下),則消耗硝酸的物質的量是
A.0.12molB.0.09molC.0.11molD.0.08mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃料電池是目前電池研究的熱點之一,現有某課外小組自制的氫氧燃料電池,如圖所示,a、b均為惰性電極。下列敘述正確的是
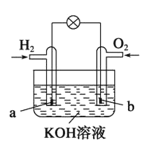
A.總反應方程式為2H2+O2![]() 2H2O
2H2O
B.a極反應是H2-2e-=2H+
C.使用過程中電解質溶液的pH逐漸減小
D.b電極是正極,該電極上發生氧化反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了將混有Na2SO4、NaHCO3的NaCl固體提純,制得純凈的氯化鈉溶液,某學習小組設計了如下圖所示的實驗方案:
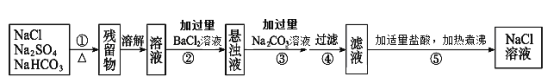
回答下列問題:
(1)操作①加熱過程中,發生反應的化學方程式是_______。
(2)操作②不用Ba(NO3)2溶液的理由是:__________。
(3)進行操作②中,判斷“BaCl2溶液是否過量”的方法是:_________。
(4)操作③“加入過量Na2CO3溶液”的目的是:________。
(5)操作⑤中“加適量鹽酸”的主要目的是__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com