
將FeCl3溶液與NH4SCN溶液混合發生如下反應
①Fe3++SCN- Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN-
Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN- Fe(SCN)2+ K2
Fe(SCN)2+ K2
紅色 深紅色
(1)已知:若起始c(Fe3+)、c(SCN-)均為0.001 mol/L,測得混合溶液中c(Fe3+)約為8.5×10-4 mol/L,c[Fe(SCN)2+]約為1.5×10-4 mol/L,c[Fe(SCN)2+]約為5×10-6 mol/L,則反應②的平衡常數K2為 。
(2)取兩份混合溶液,分別向溶液中滴加同體積同濃度的FeCl3溶液與NH4SCN溶液,溶液顏色均加深,其原因是 。仔細觀察,滴加NH4SCN溶液時,混合液顏色更深一些,其原因是 。
(3)向FeCl2與NH4SCN混合溶液中滴加酸化的H2O2溶液,溶液先變紅,寫出H2O2與Fe2+反應的離子方程式 ,繼續滴加H2O2,溶液褪色,產生大量能夠使澄清石灰水變渾濁的氣體且硫氰根中氮元素全部轉化為N2,向反應后的溶液中滴加BaCl2溶液,有不溶于稀鹽酸白色沉淀生成。寫出H2O2與SCN-反應的離子方程式 。
(4)為測定某溶液中c(Cl-),取待測液V1 mL,向其中加入V2 mL濃度為c2 mol/L的AgNO3溶液(過量),再加入少量鐵銨礬[NH4Fe(SO4)2·12H2O]作指示劑,用NH4SCN標準溶液(濃度為c3 mol/L)滴定剩余的Ag+,消耗NH4SCN溶液體積為V3 mL。(已知Ag++SCN- = AgSCN↓(白色沉淀),Ksp(AgSCN)=4.9×10-13、Ksp(Ag Cl)=1.56×10-10)。請回答:
①在用NH4SCN標準溶液滴定前,應先通過過濾除去生成的AgCl,若不過濾,則測定結果將 。(填“偏高”,“偏低”或不變)。
②最終測得c(Cl-)= mol/L。
(1)39.7
(2)兩種物質均促使①②反應向正向移動
Fe3+對反應①影響程度較大,NH4SCN不僅促進反應①正向移動,也直接促進
反應②正向移動,生成了更多的深紅色物質
(3)H2O2+2H++2Fe2+= 2Fe3++ 2H2O
2SCN-+11H2O2= 2SO42-+2CO2↑+N2↑+ 10H2O+2H+
(4)偏低 (V2 c2-V3 c3)/ V1
解析試題分析:(1)反應②的平衡常數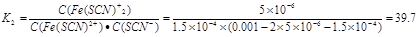
(2) 取兩份混合溶液,分別向溶液中滴加同體積同濃度的FeCl3溶液與NH4SCN溶液,由于Fe3+、SCN-的濃度都增大,使①②兩個可逆反應都向正向移動,產生更多的有色物質,實驗溶液顏色均加深。(3)向FeCl2與NH4SCN混合溶液中滴加酸化的H2O2溶液,溶液先變紅,是因為發生反應:H2O2+2H++2Fe2+= 2Fe3++ 2H2O,然后發生上述的①②反應。當繼續滴加H2O2,溶液褪色是因為又發生了反應2SCN-+11H2O2= 2SO42-+2CO2↑+N2↑+ 10H2O+2H+ ,由于消耗了SCN-,使兩個可逆反應的化學平衡都向逆反應方向移動,所以溶液的元素變淺甚至褪去。(4)①在用NH4SCN標準溶液滴定前,應先通過過濾除去生成的AgCl,若不過濾除去生成的AgCl,在進行滴定時當溶液中Ag+降低到一定濃度時,AgCl沉淀就會逐漸溶解轉化為溶液中,而與滴加的SCN-發生沉淀反應Ag++SCN- = AgSCN↓,這樣原待測溶液中Cl-消耗的Ag+就會偏少。所以測定結果將偏低。②n(SCN-)=C·V=C3·V3×10-3mol,根據Ksp(AgSCN)=4.9×10-13可得剩余的Ag+的物質的量n(Ag+)=n(SCN-) =C3·V3×10-3mol,則與Cl-的Ag+的物質的量為:(C2·V2×10-3- C3·V3×10-3)mol因為Ag++Cl-=AgCl↓所以原來的溶液中含有的氯離子的物質的量為(C2·V2×10-3- C3·V3×10-3)mol。因此最終測得c(Cl-)=n(Cl-)/V=(C2·V2×10-3- C3·V3×10-3)mol÷V3×10-3L=(C2·V2- C3·V3)÷V3mol/L.
考點:考查外界條件對化學平衡移動的影響、離子方程式的書寫及化學平衡常數、溶液中離子的濃度的計算等知識。


科目:高中化學 來源: 題型:填空題
隨著大氣污染的日趨嚴重,國家擬于“十二”五期間,將二氧化硫(SO2)排放量減少8%,氮氧化物(NOx)排放量減少10%。目前,消除大氣污染有多種方法。
(1)用CH4催化還原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) ="4NO(g)" + CO2(g) +2H2O(g) ⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g) ⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) △H=" -44.0" kJ·mol-1
寫出CH4(g)與NO2(g)反應生成N2 (g)、CO2 (g)和H2O(1)的熱化學方程式 。
(2)利用Fe2+、Fe3+的催化作用,常溫下可將SO2轉化為SO42-,從而實現對SO2的治理。已知含SO2的廢氣通入含Fe2+、Fe3+的溶液時,其中一個反應的離子方程式為4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,則另一反應的離子方程式為 。
濃度/mol·L-1
| NO | N2 | CO2 | ||
| 0 | 1.00 | 0 | 0 | ||
| 10 | 0.58 | 0.21 | 0.21 | ||
| 20 | 0.40 | 0.30 | 0.30 | ||
| 30 | 0.40 | 0.30 | 0.30 | ||
| 40 | 0.32 | 0.34 | 0.17 | ||
| 50 | 0.32 | 0.34 | 0.17 |
 N2 (g)+CO2 (g) 。某研究小組向密閉的真空容器中(假設容器體積不變,固體試樣體積忽略不計)加入NO和足量的活性炭,恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
N2 (g)+CO2 (g) 。某研究小組向密閉的真空容器中(假設容器體積不變,固體試樣體積忽略不計)加入NO和足量的活性炭,恒溫(T1℃)條件下反應,反應進行到不同時間測得各物質的濃度如下:
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Ⅰ.鋁是地殼中含量最高的金屬元素,其單質及其合金在生產生活中的應用十分廣泛。
(1)金屬鋁的生產是以Al2O3為原料,與冰晶石(Na3AlF6)在熔融狀態下進行電解,則化學方程式為 。
其電極均由石墨材料做成,則電解時不斷消耗的電極是 (填“陰極”或“陽極”)。
(2)對鋁制品進行抗腐蝕處理,可延長其使用壽命。以處理過的鋁材為陽極,在H2SO4溶液中電解,鋁材表面形成氧化膜,陽極反應式為 。
(3)鋁電池性能優越,Al-Ag2O電池可用作水下動力電源,化學反應為:2Al+3Ag2O+2NaOH+3H2O 2Na[Al(OH)4]+6Ag, 則負極的電極反應式為
2Na[Al(OH)4]+6Ag, 則負極的電極反應式為
,正極附近溶液的pH (填“變大”、“不變”或“變小”)。
Ⅱ.氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用。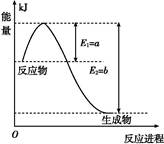
(1)如圖是在一定溫度和壓強下N2和H2反應生成1 mol NH3過程中能量變化示意圖,請寫出合成氨的熱化學反應方程式: (ΔH的數值用含字母a、b的代數式表示)。
(2)工業合成氨的反應為N2(g)+3H2(g) 2NH3(g)。在一定溫度下,將一定量的N2和H2通入體積為1 L的密閉容器中,反應達到平衡后,改變下列條件,能使平衡向正反應方向移動且平衡常數不變的是 。
2NH3(g)。在一定溫度下,將一定量的N2和H2通入體積為1 L的密閉容器中,反應達到平衡后,改變下列條件,能使平衡向正反應方向移動且平衡常數不變的是 。
| A.增大壓強 | B.增大反應物的濃度 |
| C.使用催化劑 | D.降低溫度 |
 6SO2+Fe3O4,有3 mol FeS2參加反應,轉移 mol電子。
6SO2+Fe3O4,有3 mol FeS2參加反應,轉移 mol電子。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某校同學為探究Br2、I2和Fe3+的氧化性強弱,進行了如下實驗。
實驗①:取少量KI溶液于試管中,先加入溴水、振蕩,再加入CCl4,振蕩后靜置,觀察到下層液體呈紫紅色;
實驗②:取少量FeSO4溶液于試管中,先加入溴水,振蕩,再繼續滴加兩滴KSCN溶液,振蕩,觀察到溶液呈紅色。
(1)寫出離子方程式:
實驗①:______________________________________________________;
實驗②:______________________________________________________。
(2)由上述兩個實驗,對物質的氧化性可以得出的正確結論是________。
| A.Br2>I2 | B.Fe3+>Br2 | C.Br2>Fe3+ | D.I->Br- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
現有五種可溶性物質A、B、C、D、E,它們所含陰、陽離子互不相同,分別含有五種陽離子Na+、Al3+、Mg2+、Ba2+、Fe3+和五種陰離子Cl-、OH-、NO3—、CO32—、X中的一種。
(1)某同學通過比較分析,認為無需檢驗就可判斷其中必有的兩種物質是________和________(填化學式)。
(2)為了確定X,現將(1)中的兩種物質記為A和B,含X的物質記為C,當C與B的溶液混合時,產生紅褐色沉淀和無色無味氣體;當C與A的溶液混合時產生棕黃色沉淀,向該沉淀中滴入稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。則X為________。
A.SO32— B.SO42— C.CH3COO- D.SiO32—
(3)將Cu投入到裝有D溶液的試管中,Cu不溶解;再滴加稀H2SO4,Cu逐漸溶解,管口附近有紅棕色氣體出現。則物質D一定含有上述離子中的________(填相應的離子符號)。有關反應的離子方程式為_________________________________________________________。
(4)利用上述已經確定的物質,可以檢驗出D、E中的陽離子。請簡述實驗操作步驟、現象及結論:______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某強酸性溶液X含有Ba2+、Al3+、N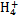 、Fe2+、Fe3+、C
、Fe2+、Fe3+、C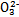 、S
、S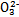 、S
、S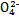 、Cl-、N
、Cl-、N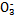 中的一種或幾種,取該溶液進行實驗,實驗內容如下:
中的一種或幾種,取該溶液進行實驗,實驗內容如下: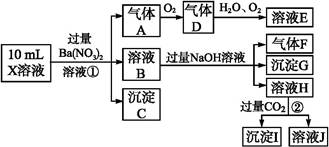
根據以上信息,回答下列問題:
(1)溶液X中除H+外還肯定含有的離子是 ;不能確定是否含有的離子是 ,若要確定其中陽離子的存在,最可靠的化學方法是 。
(2)沉淀G的化學式為 。
(3)寫出有關離子方程式:
步驟①中生成A 。
步驟②生成沉淀I 。
(4)假設測定A、F、I均為0.01 mol,10 mL X溶液中n(H+)="0.04" mol,而沉淀C物質的量0.07 mol,能說明(1)中不能確定的陰離子存在的理由是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某溶液僅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4種離子,所含離子的物質的量均為0.1mol。若向該溶液中加入過量的稀硫酸,有氣體產生,且溶液中陰離子種類不變(不考慮水的電離和離子的水解)。回答下列問題:
(1)若向該溶液中加入過量的稀硫酸和KSCN溶液,現象是: ;
(2)寫出向該溶液中加入過量的稀硫酸發生反應的離子方程式為:________________________________________________________________________;
(3)經分析,該溶液僅含的4種離子是:______________________________________;
(4)判定另外3種離子不能存在的主要依據有三個:
①向該溶液中加入過量的稀硫酸,有氣體產生,且溶液中陰離子種類不變,②所含離子的物質的量均為0.1mol,則③是__________________________________________;
(5) 若向該溶液中加入足量的NaOH溶液,將所得的沉淀過濾再灼燒,最后所得固體的質量為______g
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
A、B、C、D四種可溶性鹽,分別由Na+、Ba2+、Cu2+、Ag+、CO32—、SO42—、Cl—、NO3—中的不同陽離子和陰離子各一種組成。現做以下實驗:
① 將四種鹽各取少量,分別溶于盛有5 mL蒸餾水的四支試管中,只有B鹽溶液呈藍色。
② 分別向4支試管中加入2 mL稀鹽酸,發現A鹽溶液中產生白色沉淀,C鹽溶液中有較多氣泡產生,而D鹽溶液無明顯現象。
根據上述事實,推斷這四種鹽的化學式分別為:
A B C D
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取該溶液100mL,加入過量NaOH溶液,加熱,得到0.02mol氣體,同時產生紅褐色沉淀;將沉淀過濾、洗滌、灼燒,得到1.6g固體;向上述濾液中加入足量BaCl2溶液,得到4.66g不溶于鹽酸的沉淀。
回答下列問題:
(1)原溶液中一定不存在 。
(2)根據實驗和必要的計算確定溶液中一定存在的離子有哪些 (寫出必要的推理及計算過程)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com