短周期元素A、B、C、D、E、F、G其核外電子總數依次增多,A原子是元素中電子總數最少的,B的最外層電子數是次外層電子數的二倍,C最外層電子數是其電子層數的三倍,G與C同族且兩元素核外電子總數之和與D、E兩元素核外電子總數之和相等,F的最外電子數是次外層電子數的二分之一.
(1)寫出元素F在周期表中的位置
.
(2)由元素ABC組成的18電子物質,是假酒中常見的有毒物質之一,其電子式為
.
(3)已知這樣兩反應 G(s)+C
2(g)=GC
2(g)△H
1=-296KJ?mol
-1,2GC
3(g)?2GC
2(g)+C
2(g)△H
2=+198KJ?mol
-1 2G(s)+3C
2(g)?2GC
3(g)△H
3=
(4)對于可逆反應:2GC
2(g)+C
2(g)?2GC
3(g)△H=aKJ?mol
-1 圖中兩條曲線分別表示溫度為T
1和T
2時體系中GC
3的百分含量和時間的關系.GC
3%T
1時平衡常數K
1、T
2時平衡常數K
2,則K
1 K
2(>、<、=).T
2時在2L密閉容器中充入4moLGC
2和3moLC
2,在一定條件下達到平衡時GC
2的轉化率為90%,則這時的平衡常數數值是
.
(5)D
2FC
3溶液與E
2(GC
4)
3溶液混合產生兩種均溶于DCA溶液的難溶物質,寫出兩溶液混合所發生的離子反應方程式
(6)向Ba(AGC
3)
2溶液中滴加足量A
2C
2產生23.3克白色沉淀時,反應中電子轉移總數物質的量為
.



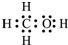 ,故答案為:
,故答案為: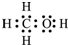 ;
;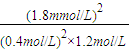 =135,故答案為:>;135;
=135,故答案為:>;135;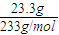 ×(6-4)=0.2mol,
×(6-4)=0.2mol,

 時刻準備著暑假作業原子能出版社系列答案
時刻準備著暑假作業原子能出版社系列答案




