
分析 堿溶液和強堿弱酸鹽的溶液顯堿性,堿能夠電離出氫氧根離子,強堿弱酸鹽在溶液中水解生成氫氧根離子顯堿性.
解答 解:a.NH3•H2O屬于弱堿在溶液中部分電離出氫氧根離子溶液顯堿性,其電離方程式為:NH3.H2O=NH4++OH-;
b.NaAlO2 為強堿弱酸鹽在溶液中水解生成氫氧根離子顯堿性,其水解方程式為:AlO2-+2H2O=Al(OH)3+OH-;
c.NH4Cl屬于強酸弱堿鹽,在溶液中水解顯酸性;
d.NaHSO4在溶液中完全電離出氫離子和鈉離子,溶液顯酸性;
故答案為:a、b;NH3.H2O=NH4++OH-、AlO2-+2H2O=Al(OH)3+OH-.
點評 本題考查了弱電解質的電離和鹽的水解,題目難度不大,側重于基礎知識的考查,注意把握水解原理和規律.


 寒假樂園北京教育出版社系列答案
寒假樂園北京教育出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 根據甲烷分子中四個鍵的鍵角相等,就可推知甲烷為正四面體結構 | |
| B. | 分子式為C4H8的烯烴與氫氣加成反應后得到的烷烴有3種 | |
| C. | 乙烷和丙烯的物質的量共1 mol,完全燃燒生成3 mol H2O | |
| D. | 苯中無碳碳雙鍵,化學性質穩定,不能發生氧化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 、④HCHO,其中碳原子采取sp2雜化的分子有①③④(填物質序號),HCHO分子的立體結構為平面三角形.
、④HCHO,其中碳原子采取sp2雜化的分子有①③④(填物質序號),HCHO分子的立體結構為平面三角形.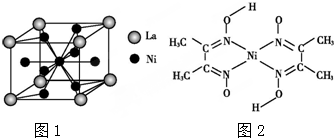
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2的飽和溶液中Na+、NH4+、C6H5O-、SO42- | |
| B. | 甲基橙變紅的溶液中液中K+、Ca2+、AlO2-、NO3- | |
| C. | 0.1mol•L-1NH4Cl溶液中K+、Na+、HCO3-、SO42- | |
| D. | 與Al反應生成H2的溶液中Na+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | pH=3的醋酸溶液與pH=11的NaOH溶液等體積混合,則c (Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 等物質的量濃度的NH4HSO4、NH4HCO3溶液中c(NH4+)大小:NH4HSO4>NH4HCO3 | |
| C. | 0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某堿)溶液中c(OH-)=0.1 mol/L,則BA(鹽)溶液pH<7 | |
| D. | 4種pH相同的溶液①CH3COONa ②C6H5ONa ③NaHCO3 ④NaOH中c(Na+)的大小順序是①>②>③>④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 盛放燒堿的試劑瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 切開的金屬Na暴露在空氣中,光亮表面逐漸變暗 4 Na+O2=2Na2O | |
| C. | 燃煤中加入石灰石可以減少SO2的排放:O2+2CaCO3+2SO2=2CO2+2CaSO4 | |
| D. | 酸性KI淀粉溶液久置后變藍:4I-+O2+2H2O=2I2+4OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陳述I | 陳述Ⅱ | 判斷 | |
| A | 鐵是地殼中含量最高的金屬元素 | 鐵是人類最早使用的金屬材料 | I對;Ⅱ對;有 |
| B | 常溫下鐵與稀硫酸反應生成氫氣 | 高溫下氫氣能還原氧化鐵得到鐵 | I對;Ⅱ對;無 |
| C | 鐵屬于過渡元素 | 鐵的某些化合物可用作催化劑 | I錯;Ⅱ對;無 |
| D | 在空氣中鐵表面形成致密氧化膜 | 鐵不能與氧氣反應 | I對;Ⅱ對;有 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氣體物質加壓或降溫時能凝結或凝固 | |
| B. | 碘溶于四氯化碳 | |
| C. | 氟、氯、溴、碘單質的熔沸點依次升高 | |
| D. | 食鹽熔化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com