
【題目】下列方案不能達到實驗目的的是
A. 用碘水鑒別淀粉溶液和食鹽水
B. 用澄清石灰水鑒別Na2CO3和NaHCO3溶液
C. 用丁達爾效應鑒別FeCl3溶液和Fe(OH)3膠體
D. 除去Cl2中HCl,將混合氣體依次通過飽和食鹽水和濃硫酸
 開心練習課課練與單元檢測系列答案
開心練習課課練與單元檢測系列答案 開心試卷期末沖刺100分系列答案
開心試卷期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】現有一份含有FeCl3和FeCl2固體混合物,為測定各成分的含量進行如下兩個實驗:
實驗1:① 稱取一定質量的樣品,將樣品溶解;
② 向溶解后的溶液中加入足量的AgNO3溶液,產生沉淀;
③ 將沉淀過濾、洗滌、干燥得到白色固體17.22 g。
實驗2:① 稱取與實驗1中相同質量的樣品,將樣品溶解;
② 向溶解后的溶液中通入足量的Cl2;
③ 再向②所得溶液中加入足量的NaOH溶液,得到紅褐色沉淀;
④ 將沉淀過濾、洗滌后,加熱灼燒,到質量不再減少,得到固體物質4g。
回答下列問題:
(1)溶解過程中所用到的玻璃儀器有___________________。
(2)實驗室保存FeCl2溶液時通常會向其中加入少量試劑_____________和_____________。
(3)實驗2通入足量Cl2的目的是________ ;
涉及的化學反應的離子方程式是______ _。
(4)如何檢驗溶解樣品中含有Fe2+ 。
(5)通過實驗所得數據,計算固體樣品中FeCl3和FeCl2的物質的量之比為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式的書寫及評價,均合理的是
選項 | 離子方程式 | 評價 |
A | 將2 mol Cl2通入到含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正確;Cl2過量,可將Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液與足量的NaOH溶液反應: Ba2++HCO | 正確;酸式鹽與堿反應生成正鹽和水 |
C | 過量SO2通入到NaClO溶液中: SO2+H2O+ClO-===HClO+HSO | 正確;說明酸性: H2SO3強于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等體積互相均勻混合: 2AlO | 正確;AlO |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA代表阿伏伽德羅常數的值,下列敘述正確的是
A.1 L 1 mol/L FeBr2溶液與1 mol氯氣反應時轉移的電子數為3NA
B.0.5 mol/L硫酸鈉溶液中含有溶質離子總數為1.5NA
C.1 mol硫酸氫鈉固體中含陽離子總數NA
D.28 g由乙烯和聚乙烯組成的混合氣體中含有碳碳雙鍵數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為制取硝酸銅,某同學設計了如下四種方法:①銅與濃硝酸反應制取硝酸銅;②銅與稀硝酸反應制取硝酸銅;③銅先與空氣反應制取氧化銅,再與硝酸反應制取硝酸銅;④銅與硝酸銀溶液反應制取硝酸銅。
(1)方法②中被氧化的銅與被還原的硝酸的物質的量之比是 。
(2)“綠色化學”是當今社會提出的一個新概念。在“綠色化學”工藝中,杜絕污染源,提高原子利用率是綠色化學的重要衡量指標。請從“綠色化學”和經濟效益角度考慮,大量制取硝酸銅宜采用上述第 (填序號)種方法,原因是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某學生的化學實驗報告中有如下記錄其中實驗數據合理的( )
A. 用100 mL量筒量取5.26 mL稀硫酸溶液
B. 用托盤天平稱取11.7 g CuO粉末
C. 用廣泛pH試紙測得溶液的pH為3.5
D. 溫度計上顯示的室溫讀數為25.68oC
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,溶液的酸堿性對TiO2光催化染料R降解反應的影響如圖所示。下列判斷正確的是
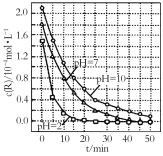
A.R的起始濃度越小,降解速率越大
B.在0~50 min之間,pH=2和pH=7時R的降解百分率相等
C.溶液酸性越強,R的降解速率越小
D.在20~25 min之間,pH=10時R的平均降解速率為0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述錯誤的是
A. 生鐵中含有碳,抗腐蝕能力比純鐵弱
B. 用錫焊接的鐵質器件,焊接處易生銹
C. 在鐵制品上鍍銅時,鍍件為陽極,銅鹽為電鍍液
D. 鐵管上鑲嵌鋅塊,鐵管不易被腐蝕
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com