

(1)0—t1速率變化的原因是______________________________。
(2)t1—t2速率變化的原因是______________________________。
解析:此題考查酸和金屬反應的實質、特點(放熱),以及綜合考慮濃度、溫度對化學反應速率的影響,從而對影響反應速率的時間變化曲線圖象,提出合理的解釋。
Zn與稀H2SO4反應產生H2的離子方程式為Zn+2H+![]() Zn2++H2↑,最初c(H+)大,反應速率較快,由于Zn與稀硫酸反應為放熱反應,隨反應進行,溫度升高,而c(H+)沒有明顯降低,故反應速率加快;故t1之前v(H2)逐漸增大;t1之后,c(H+)明顯降低,反應速率降低,故v(H2)又逐漸減小。
Zn2++H2↑,最初c(H+)大,反應速率較快,由于Zn與稀硫酸反應為放熱反應,隨反應進行,溫度升高,而c(H+)沒有明顯降低,故反應速率加快;故t1之前v(H2)逐漸增大;t1之后,c(H+)明顯降低,反應速率降低,故v(H2)又逐漸減小。
答案:(1)Zn與稀H2SO4反應為放熱反應,隨反應進行,溫度升高,c(H+)減小,但溫度升高是主要因素,所以反應速率加快
(2)雖然反應繼續放熱,但c(H+)降低是主要因素,所以反應速率降低


科目:高中化學 來源:設計必修二化學蘇教版 蘇教版 題型:022
下圖所示為將Zn投入一定濃度一定體積的H2SO4溶液中,解釋圖象的成因(縱坐標為H2的生成速率).
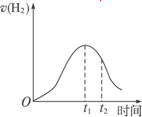
(1)0-t1速率變化的原因是________.
(2)t1-t2速率變化的原因是________.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com