
【題目】化學在生產、生活中有著廣泛應用,下列說法中錯誤的是
A.依次使用![]() 溶液和鹽酸,可除去鍋爐水垢中的
溶液和鹽酸,可除去鍋爐水垢中的![]()
B.草木灰溶液能夠去除油污
C.低血糖癥狀出現時,吃饅頭要比喝葡萄糖水見效快
D.若發生液氨泄漏,人應盡量往上風向處較低的位置轉移
科目:高中化學 來源: 題型:
【題目】常溫下,用0.1000 mol/L NaOH溶液分別滴定20.00 mL 0.1000 mol/L HCl溶液和20.00 mL 0.1000 mol/LCH3COOH溶液,得到2條滴定曲線,如下圖所示:

以下說法正確的是( )
A.圖1是滴定CH3COOH 溶液的曲線
B.圖2若用甲基橙作指示劑達到滴定終點時,則溶液由黃色變為紅色
C.點D所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.如果C、E兩點對應的pH分別為3、9,則水電離的氫離子濃度之比為1∶106
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰-空氣電池是一種新型的二次電池,其放電時的工作原理如圖所示,下列說法正確的是

A. 該電池放電時,正極的反應式為O2+4e-+4H+=2H2O
B. 該電池充電時,陰極發生了氧化反應:Li++e-=Li
C. 電池中的有機電解液可以用稀鹽酸代替
D. 充電時,空氣極與直流電源正極相連
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上常用還原沉淀法處理含鉻廢水(![]() 和
和![]() ),其流程為:
),其流程為:
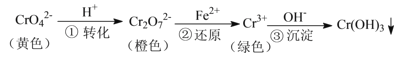
已知:步驟③生成的![]() 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:![]()
![]() ,
,![]()
下列有關說法不正確的是
A.步驟①中當![]() 時,說明反應:
時,說明反應:![]() 達到平衡狀態
達到平衡狀態
B.若向![]() 溶液中加NaOH濃溶液,溶液可由橙色變黃色
溶液中加NaOH濃溶液,溶液可由橙色變黃色
C.步驟②中,若要還原![]() 離子,需要
離子,需要![]()
D.步驟③中,當將溶液的pH調節至5時,可認為廢水中的鉻元素已基本除盡![]() 當溶液中
當溶液中![]() 時,可視作該離子沉淀完全
時,可視作該離子沉淀完全![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列相關方程式或離子方程式正確的是
A.碳酸的電離方程式:H2CO3![]() 2H++CO32-
2H++CO32-
B.向沸水中滴加飽和FeCl3溶液制膠體:Fe3++3 H2O![]() Fe(OH)3(膠體)+3 H+
Fe(OH)3(膠體)+3 H+
C.泡沫滅火器原理可表示為:2Al3++3CO32-+3 H2O=2Al(OH)3↓+3CO2↑
D.NaClO溶液呈堿性:ClO—+H2O![]() HClO+OH-
HClO+OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用![]() 代替
代替![]() 與燃料反應是一種高效、清潔、經濟的新型燃燒技術,如圖所示。
與燃料反應是一種高效、清潔、經濟的新型燃燒技術,如圖所示。
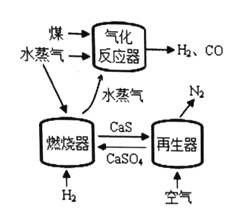
燃燒器中反應①![]() (主反應)
(主反應)
反應②![]() (副反應)
(副反應)
再生器中反應:![]()
(1)氣化反應器中發生反應的化學方程式是 ______。
(2)燃燒器中![]() 物質的量分數隨溫度T、壓強p
物質的量分數隨溫度T、壓強p![]() 的變化曲線見圖,從圖中可以得出三條主要規律:
的變化曲線見圖,從圖中可以得出三條主要規律:
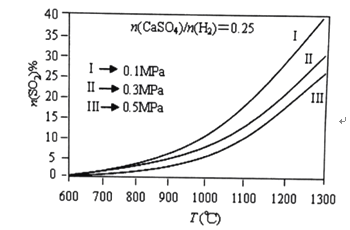
①其他條件不變,溫度越高,![]() 含量越高;
含量越高;
②______ ;
③______ ;
由圖可知,為減少![]() 的排放量,可采取的措施是 ______。
的排放量,可采取的措施是 ______。
(3)該燃燒技術中可循環的物質除![]() 、CaS外,還有 ______
、CaS外,還有 ______ ![]() 寫名稱
寫名稱![]() 。
。
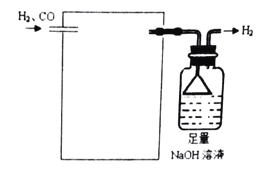
(4)欲采用氯化鈀![]() 溶液除去
溶液除去![]() 中的CO,完成以下實驗裝置圖:______
中的CO,完成以下實驗裝置圖:______![]() 注:
注:![]() 。
。
(5)CO2在自然界循環時可與![]() 反應,
反應,![]() 是一種難溶物質,其
是一種難溶物質,其![]() 。現將
。現將![]()
![]() 的
的![]() 溶液與一定濃度的
溶液與一定濃度的![]() 溶液等體積混合生成沉淀,計算應加入
溶液等體積混合生成沉淀,計算應加入![]() 溶液的最小濃度為 ______(保留二位有效數字)。
溶液的最小濃度為 ______(保留二位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醋酸溶液中存在電離平衡CH3COOH![]() H++CH3COO-,下列敘述不正確的是( )
H++CH3COO-,下列敘述不正確的是( )
A.0.1 mol·L-1的CH3COOH溶液加水稀釋,溶液中c(OH-)增大
B.0.1 mol·L-1的醋酸溶液,由水電離出來的c(H+)=1.0×10-13 mol·L-1
C.CH3COOH溶液中加少量的CH3COONa固體,平衡逆向移動
D.常溫下,pH=2的醋酸溶液與pH=12的NaOH溶液等體積混合后,溶液的pH<7
查看答案和解析>>
科目:高中化學 來源: 題型:
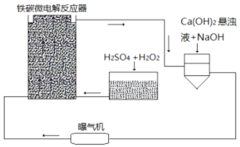
【題目】鐵碳微電解技術是近年來處理各種污水的一種重要方法,其裝置如圖所示。
請回答下列問題:
(1)當污水通過鐵碳微電解反應器時,會形成數量巨大的微小電池,這些微小電池的負極為______,若污水為酸性溶液,且通過曝氣機鼓入充足的空氣,正極反應式為:______。
(2)其治理污水原理主要有以下幾個方面:
①一些不活潑的重金屬離子被Fe置換出來。寫出從![]() 中置換金的離子方程式______。
中置換金的離子方程式______。
②在處理過程中,有些膠體會發生電泳,向某極富集,從而聚沉除去。![]() 膠體電泳時,會向______極移動。
膠體電泳時,會向______極移動。
③吸附作用。Fe、C、![]() 、
、![]() 等都有吸附作用,可以吸附一些懸浮物質。以上四種物質都有吸附性是因為______。
等都有吸附作用,可以吸附一些懸浮物質。以上四種物質都有吸附性是因為______。
A.都有還原性![]() 表面積都很大
表面積都很大![]() 都含金屬元素
都含金屬元素![]() 都是膠體
都是膠體
④過程中產生的![]() 能沉淀或結合一些無機陰離子
能沉淀或結合一些無機陰離子![]() 例如
例如![]() 生成FeS沉淀
生成FeS沉淀![]() 。由FeS制備
。由FeS制備![]() 氣體可選用______。
氣體可選用______。
A.稀硫酸![]() 稀硝酸
稀硝酸![]() 稀鹽酸
稀鹽酸![]() 濃硫酸
濃硫酸
(3)溶液中的Fe元素最終均轉化為![]() 沉淀除去。為更好除去
沉淀除去。為更好除去![]() 和
和![]() ,請參考裝置圖,從試劑用量角度提出可以采取哪些措施
,請參考裝置圖,從試劑用量角度提出可以采取哪些措施![]() 回答一條即可
回答一條即可![]() ______。
______。
(4)已知常溫下,![]() ;
;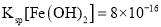 。
。
①計算![]() 的水解常數為______。
的水解常數為______。
②向飽和![]() 、
、![]() 混合溶液中,逐漸加入少量固體
混合溶液中,逐漸加入少量固體![]() 忽略體積和溫度變化
忽略體積和溫度變化![]() ,
,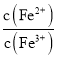 會______,
會______,![]() 選填“逐漸增大”、“逐漸減小”、“不變”
選填“逐漸增大”、“逐漸減小”、“不變”![]() 。結合相關數據推理說明原因______。
。結合相關數據推理說明原因______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.某無色澄清透明溶液中:K+ H+ Fe2+ Cl-
B.含0.1 mol·L-1OH-的溶液中:Na+ K+ ![]() ClO-
ClO-
C.含0.1 mol·L-1![]() 的溶液中:K+ Ca2+
的溶液中:K+ Ca2+ ![]()
![]()
D.含0.1 mol·L-1OH-的溶液中:Fe3+ ![]() Cu2+
Cu2+ ![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com