
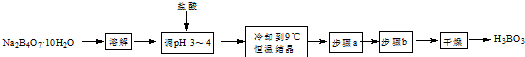
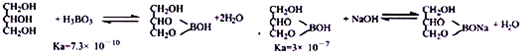
分析 用硼砂制取硼酸并測定硼酸樣品的純度,硼砂溶解后加入鹽酸調節溶液PH為3-4,冷卻到9°C,恒溫結晶,過濾洗滌干燥得到硼酸,
(1)固體溶解需要燒杯和玻璃棒;
(2)pH試紙測定溶液pH的操作方法是用干燥潔凈的玻璃棒蘸取待測溶液點在試紙中央,半分鐘內與標準比色卡進行對照得到溶液PH;
(3)用鹽酸酸化硼砂溶液生成硼酸反應為:B4O72-+2H++5H2O=4H3BO3;
(4)依據上述分析可知操作步驟是過濾洗滌;
(5)①滴定過程中加入的指示劑是酚酞溶液,滴入氫氧化鈉溶液到反應終點,溶液顏色由無色變化為淺紅色證明反應達到終點;
②分析滴定原理和反應的定量關系計算;
③若滴定時滴定管尖嘴部分有氣泡,滴定過程中消失,則消耗標準溶液體積增大,依據c(待測)=$\frac{c(標準)V(標準)}{V(待測)}$,測定結果偏大.
解答 解:用硼砂制取硼酸并測定硼酸樣品的純度,硼砂溶解后加入鹽酸調節溶液PH為3-4,冷卻到9°C,恒溫結晶,過濾洗滌干燥得到硼酸;
(1)固體溶解需要燒杯和玻璃棒,溶解硼砂時需要的玻璃儀器有:燒杯和玻璃棒;
故答案為:玻璃棒;
(2)pH試紙測定溶液pH的操作方法是用干燥潔凈的玻璃棒蘸取待測溶液點在試紙中央,半分鐘內與標準比色卡進行對照得到溶液PH,用干燥潔凈的玻璃棒蘸取待測溶液點在試紙中央,半分鐘內與標準比色卡進行對照,判斷溶液的pH;
故答案為:用干燥潔凈的玻璃棒蘸取待測溶液點在試紙中央,半分鐘內與標準比色卡進行對照,判斷溶液的pH;
(3)硼砂中弱酸陰離子結合氫離子在溶液中生成硼酸,用鹽酸酸化硼砂溶液生成硼酸反應的離子方程式為:B4O72-+2H++5H2O=4H3BO3;
故答案為:B4O72-+2H++5H2O=4H3BO3;
(4)依據上述分析可知實驗流程中缺少的步驟a、步驟b操作分別為過濾、洗滌;
故答案為:過濾、洗滌;
(5)①分析流程可知,滴定過程中加入的指示劑是酚酞溶液,滴入氫氧化鈉溶液到反應終點的現象為,滴入最后一滴溶液顏色由無色變化為淺紅色且半分鐘不變化,證明反應達到終點,滴定到終點時溶液顏色變化是由無色變為淺紅色;
故答案為:由無色變為淺紅色;
②分析滴定原理和反應的定量關系計算,實驗室常采用間接滴定法,其原理為: ,
,
若滴定到終點時消耗NaOH標準溶液22.00mL,氫氧化鈉溶液濃度為0.2000mol/L,
H3BO3~NaOH
1 1
n 0.0220L×0.2000mol/L
n=0.0044mol
則本次滴定測得的硼酸樣品中硼酸的質量分數=$\frac{0.0044mol×62g/mol}{0.3000g}$×100%=90.93%;
故答案為:90.93%;
③若滴定時滴定管尖嘴部分有氣泡,滴定過程中消失,則消耗標準溶液體積增大,測定結果偏大;
故答案為:偏大.
點評 本題考查了物質制備的流程分析判斷,物質性質和實驗過程判斷,滴定實驗的操作過程和計算應用,掌握基礎是關鍵,題目難度中等.


 智慧課堂密卷100分單元過關檢測系列答案
智慧課堂密卷100分單元過關檢測系列答案 單元期中期末卷系列答案
單元期中期末卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | NiO(OH) 2的氧化 | B. | NiO(OH)的還原 | C. | H2O的氧化 | D. | H2O的還原 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 氫氧化物 | Fe(OH)3 | Fe(OH)2 |
| 開始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 序號 | 物質 | 雜質 | 除雜試劑或操作方法 |
| ① | NaCl溶液 | Na2CO3 | 加入鹽酸,蒸發 |
| ② | FeSO4溶液 | CuSO4 | 加入過量鐵粉并過濾 |
| ③ | H2 | CO2 | 依次通過盛有NaOH溶液和濃硫酸的洗氣瓶 |
| ④ | NaNO3 | CaCO3 | 加稀鹽酸溶解、過濾、蒸發、結晶 |
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 ;AB2的結構式是O=C=O.
;AB2的結構式是O=C=O.查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
| 元素代號 | A | B | C | D | E | F | G |
| 原子半徑/nm | 0.037 | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
| 主要化合價 | +1 | +2 | +3 | +6、-2 | -1 | -2 | +5、-3 |
 ;
; NH4++NH2-.
NH4++NH2-.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 雜質 | 加入試劑 | 化學方程式 |
| 硫酸鹽 | ||
| MgCl2 | ||
| CaCl2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com