
【題目】下列溶液中溶質的物質的量濃度為1 mol/L的是( )
A. 將40gNaOH固體溶于1L水中
B. 將22.4 L氯化氫氣體溶于水配成1L溶液
C. 將1L 10mol/L的濃鹽酸與9L水混合
D. 將10g NaOH固體溶解在水中配成250 mL溶液
 教學練新同步練習系列答案
教學練新同步練習系列答案科目:高中化學 來源: 題型:
【題目】某化學實驗小組為了驗證SO2和Cl2的漂白性,設計了如下圖所示的實驗裝置。請回答下列問題:
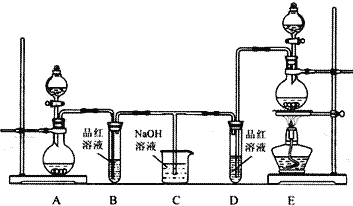
(1)他們制備SO2和Cl2所依據的原理分別是:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑、MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O,則上圖A、E裝置中用來制Cl2的裝置是______(填序號),反應中鹽酸所表現的性質是______性和______性,生成71gCl2轉移的電子是______mol;
MnCl2+Cl2↑+2H2O,則上圖A、E裝置中用來制Cl2的裝置是______(填序號),反應中鹽酸所表現的性質是______性和______性,生成71gCl2轉移的電子是______mol;
(2)反應開始后,發現B、D試管中的現象均為____________________________,停止通氣后,給B、D兩個試管中的溶液加熱,B試管中的現象是________________________________;
(3)裝置C的作用是____________________________________________________________;
(4)NaOH(足量)溶液與Cl2反應的離子方程式是__________________________________;
(5)該小組同學將兩種氣體混合后通入品紅溶液,一段時間后,品紅溶液幾乎不褪色。查閱資料得知:兩種氣體按體積比1:1混合,再與水反應可生成兩種常見酸,因而失去漂白作用。該反應的化學方程式為______________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】計算:
(1)用14.2g無水硫酸鈉配制成500mL溶液,其物質的量濃度為____mol·L-1。
(2)若從中取出50mL,其物質的量濃度為____mol·L-1;溶質的質量為___g。
(3)若將這50mL溶液用水稀釋到100mL,所得溶液中Na+的物質的量濃度為____mol·L-1,SO42-的物質的量濃度為_____mol·L-1。
(4)已知:a g某氣體A含有b個分子,則c g該氣體在標準狀況下的體積為____ L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2SO2(g)+O2(g) ![]() 2SO3(g)是制備硫酸的重要反應。下列敘述正確的是( )
2SO3(g)是制備硫酸的重要反應。下列敘述正確的是( )
A. 催化劑V2O5不改變該反應的逆反應速率
B. 保持容器體積不變,通入稀有氣體增大反應體系的壓強,反應速率一定增大
C. 該反應是放熱反應,降低溫度將縮短反應達到平衡的時間
D. 在t1、t2時刻,SO3(g)的濃度分別是c1、c2,則時間間隔t1~t2內,SO3(g)生成的平均速率為v=(c2-c1)/(t2-t1)
查看答案和解析>>
科目:高中化學 來源: 題型:
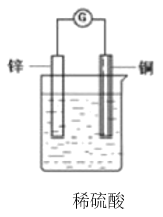
【題目】把一塊鋅片和一塊銅片平行地插入盛有稀硫酸溶液的燒杯中,觀察到的現象是________,再用導線把鋅片和銅片連接起來,在導線中間接入靈敏電流計,靈敏電流計上觀察到的現象是________;該原電池中電子流動的方向是________,總反應的化學方程式是________,其中________元素被氧化,________極上發生還原反應;在上述化學方程式上方用單線橋標出電子轉移的方向和數目。___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】廢水中過量的氨氮(NH3和NH4+)會導致水體富營養化。某科研小組用NaClO氧化法處理氨氮廢水。已知:①HClO的氧化性比NaClO強;②NH3比NH4+更易被氧化;③國家標準要求經處理過的氨氮廢水pH要控制在6~9。
(1)pH=1.25時,NaClO可與NH4+反應生成N2等無污染物質,該反應的離子方程式為_____。
(2)進水pH對氨氮去除率和出水pH的影響如下圖所示

①進水pH為1.25~2.75范圍內,氨氮去除率隨pH升高迅速下降的原因是_____
②進水pH為2.75~6.00范圍內,氨氮去除率隨pH升高而上升的原因是_____
③進水pH應控制在_____左右為宜。
(3)為研究空氣對NaClO氧化氨氮的影響,其他條件不變,僅增加單位時間內通入空氣的量,發現氨氮去除率幾乎不變。其原因可能是_____(填字母)。
a.O2的氧化性比NaClO弱 b.O2氧化氨氮速率比NaClO慢
c.O2在溶液中溶解度比較小 d.空氣中的N2進入溶液中
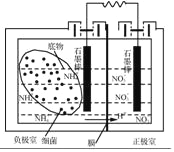
(4)利用微生物燃料電池可以對氨氮廢水進行處理,其裝置如圖所示。閉合電路后,負極室與正極室均產生氮氣,則負極室中NH4+發生反應的電極反應式為_____。該裝置除了能對氨氮廢水進行處理外,另一個突出的優點是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是( )
A. 鐵與稀硫酸反應:2Fe+6H+=2Fe3++3H2↑
B. 鐵片與氯化銅溶液反應:Fe+Cu2+=Cu+Fe2+
C. 氫氧化鎂溶于鹽酸:Mg(OH)2+H+=Mg2++H2O
D. Cu(OH)2與稀硫酸反應:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,某反應達平衡,平衡常數K=c(CO).c(H2O)/[c(CO2).c(H2)]。保持容器容積不變,升高溫度,H2濃度減小,則下列說法不正確的是
A. 該反應的焓變為正值
B. 恒溫恒容下,再充入CO2氣體,H2濃度一定減小
C. 升高溫度,會使正反應速率增大,逆反應速率減小,平衡正移
D. 該反應化學方程式為CO2+H2![]() CO+H2O
CO+H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com