
分析 (1)配制一定物質的量濃度的溶液時都需要定量儀器100mL容量瓶,都需要的儀器是燒杯、玻璃棒、膠頭滴管;
(2)弱電解質在水溶液里部分電離,導致溶液中氫離子濃度小于酸濃度;反應速率與離子濃度成正比;
(3)配制pH=l的HA溶液難以實現,實驗操作中金屬的表面積相同難控制;
(4)強堿弱酸鹽溶液呈堿性,根據NaA鹽溶液pH大小判斷HA的酸性強弱.
解答 解:(1)兩種配制方法中都需要用到定量儀器是100mL容量瓶,都需要的儀器是燒杯、玻璃棒、膠頭滴管,但甲需要天平、乙需要量筒,
故答案為:100mL的容量瓶;
(2)弱電解質在水溶液里部分電離,導致溶液中氫離子濃度小于酸濃度,如果0.1mol/L的HA中pH>1,就說明HA部分電離,為弱電解質;
酸和相同金屬反應時,反應速率取決于氫離子濃度,乙中氫離子濃度大于甲,所以乙中反應速率較快,故選(b);
故答案為:>;(b);
(3)在溶液配制過程中,加水稀釋促進弱電解質電離,所以配制pH=1的溶液難以實現,鋅粒的表面積難以控制相同,
故答案為:加入的鋅粒難以做到表面積相同;
(4)判斷酸強弱還可以根據其鈉鹽溶液pH大小判斷,如果配制的NaA的溶液pH>7,說明NaA為強堿弱酸鹽,則證明HA為弱電解質,
故答案為:配制NaA的鹽溶液,測其pH>7,HA為弱電解質.
點評 本題考查弱電解質的判斷,明確強弱電解質的本質區別是電離程度,判斷弱酸的方法有:一定物質的量濃度酸溶液pH大小、其鈉鹽溶液酸堿性、與相同濃度相同元數的強酸比較導電性強弱等,注意(2)中反應速率與離子濃度有關,與電解質強弱無關,為易錯點.


科目:高中化學 來源: 題型:選擇題
| A. | 0.44s | B. | 1s | C. | 7.33s | D. | 2s |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 烴是指分子里含有碳、氫元素的化合物 | |
| B. | 烴是指分子里含有碳元素的化合物 | |
| C. | 烴是指燃燒后能生成CO2和H2O的化合物 | |
| D. | 烴是指僅由碳和氫兩種元素組成的化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向苯酚鈉溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | 用石墨作電極電解氯化鎂溶液:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 向NH4HCO3溶液中滴加過量Ba(OH)2溶液:HCO3-+OH-+Ba2+═H2O+BaCO3↓ | |
| D. | NaAlO2溶液中通入過量二氧化碳:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
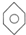 和
和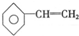 ; E.
; E.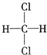 和
和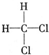 ; F.
; F.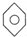 和
和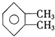 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CaCO3═CaO+CO2↑ | B. | Na2CO3+2HCl═2NaCl+CO2↑+H2O | ||
| C. | 2Fe3++Cu═2Fe2++Cu2+ | D. | BaCl2+H2SO4═BaSO4↓+2HCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
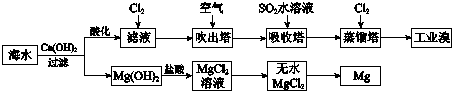
| A. | 工業溴中含少量Cl2,可用NaOH溶液除去 | |
| B. | 工業上常利用電解熔融MgCl2冶煉金屬鎂 | |
| C. | 富集溴元素過程中,空氣吹出法利用了溴易揮發的性質 | |
| D. | 若提取1 mol Br2,至少需要標準狀況下44.8 L的Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 50% | B. | 80% | C. | 88% | D. | 95% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com