
【題目】下列反應中,氧化劑與還原劑物質的量的關系不是1∶2的是
A.O3+2KI+H2O===2KOH+I2+O2
B.3NO2+H2O===2HNO3+NO
C.3S+6NaOH===Na2SO3+2Na2S+3H2O
D.4HCl(濃)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
【答案】C
【解析】
氧化還原反應中化合價降低得電子的物質為氧化劑,化合價升高失電子的是還原劑,結合方程式判斷。
A.O3+2KI+H2O═2KOH+I2+O2,反應中O3為氧化劑,KI為還原劑,則氧化劑與還原劑物質的量之比為1:2,故A不選;
B.3NO2+H2O═2HNO3+NO,反應中1molNO2得電子為氧化劑,2molNO2失電子為還原劑,則氧化劑與還原劑物質的量之比為1:2,故B不選;
C.3S+6NaOH═Na2SO3+2Na2S+3H2O反應中2molS得電子為氧化劑,1molS失電子為還原劑,則氧化劑與還原劑物質的量之比為2:1,故C選;
D.4HCl(濃)+MnO2![]() MnCl2+Cl2↑+2H2O,反應中1molMnO2得電子為氧化劑,2molHCl失電子為還原劑,則氧化劑與還原劑物質的量之比為1:2,故D不選;
MnCl2+Cl2↑+2H2O,反應中1molMnO2得電子為氧化劑,2molHCl失電子為還原劑,則氧化劑與還原劑物質的量之比為1:2,故D不選;
答案選C。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】次硫酸氫鈉甲醛(NaHSO2·HCHO·2H2O)俗稱吊白塊,不穩定,120℃時會分解。在印染、醫藥以及原子能工業中有廣泛應用。以Na2SO3、SO2、HCHO和鋅粉為原料制備次硫酸氫鈉甲醛的實驗步驟如下:
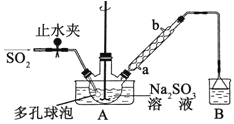
步驟1:在三頸燒瓶中加入一定量Na2SO3和水,攪拌溶解,緩慢通入SO2,至溶液pH 約為4,制得NaHSO3溶液。
步驟2:將裝置A 中導氣管換成橡皮塞。向燒瓶中加入稍過量的鋅粉和一定量甲醛溶液,在80~90℃下,攪拌(防止生成沉淀覆蓋在鋅粉表面阻止反應進行),反應約3h,冷卻至室溫,抽濾;
步驟3:將濾液真空蒸發濃縮,冷卻結晶。
⑴裝置B 的燒杯中應加入的溶液是__________________________________________。
⑵A中多孔球泡的作用是_______________________________________________。
⑶冷凝管中回流的主要物質除H2O 外還有__________________________(填化學式)。
⑷寫出步驟2中發生反應的化學方程式____________________________。
⑸步驟3中在真空容器中蒸發濃縮的原因是__________________________________。
⑹①抽濾時使用如下裝置,其中a和b的名稱分別__________、 __________。中途停止抽濾時應 ___________________________以防倒吸。
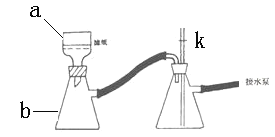
②如果抽濾的溶液具有強氧化性時,可采取_________________________________的措施
⑺為了測定產品的純度,準確稱取2.000g樣品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入過量碘完全反應后(已知I2不能氧化甲醛,雜質不反應),加入BaCl2溶液至沉淀完全,過濾、洗滌、干燥至恒重得到白色固體0.466g,則所制得的產品的純度為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A.利用濃硝酸與蛋白質的顏色反應,可鑒別含有苯環的蛋白質
B.用新制氫氧化銅可以鑒別丙三醇、丙醛、丙酸
C.甘氨酸可以以![]() 的形式從水溶液中結晶析出
的形式從水溶液中結晶析出
D.除去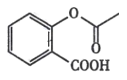 中的雜質
中的雜質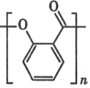 :加足量飽和NaHCO3溶液 ,過濾
:加足量飽和NaHCO3溶液 ,過濾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.治療胃酸過多的藥物達喜(其式量不超過 700)由五種短周期元素組成,按如下流程進行實驗以確定其組成。
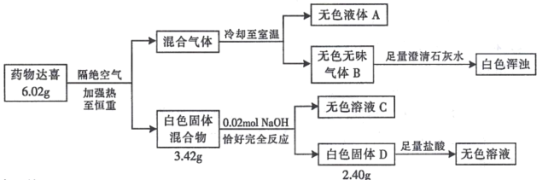
請回答:
(1)達喜的化學式是_____________。
(2)達喜與胃酸(含稀鹽酸)反應的化學方程式是____________。
(3)氣體 B 與環氧丙烷(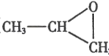 )可制得一種可降解高聚物,該反應的化學方程式是_____________________(有機物用結構簡式表示)。
)可制得一種可降解高聚物,該反應的化學方程式是_____________________(有機物用結構簡式表示)。
II.將 NaC1O3 溶液逐滴加入到碘單質和過量鹽酸的混合液中可制備液態 ICl,實驗裝置如下圖:
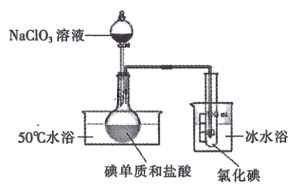
請回答:
(1)圓底燒瓶中發生的化學反應是______________( 用化學方程式表示)。
(2)若加入的 NaClO3 溶液已足量,請設計實驗方案證明該反應已完全:_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組利用Cl-取代[Co(NH3)6]3+離子中的NH3方法,制備配合物X:[Co(NH3)5Cl]Cl2。實驗過程如下:
CoCl2﹒6H2O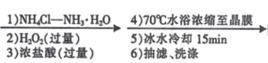 [Co(NH3)5Cl]Cl2晶體
[Co(NH3)5Cl]Cl2晶體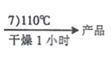
已知:
a.配合物X 能溶于水,且溶解度隨溫度升高而增大。
b.[Co( NH3)5Cl]2+離子較穩定,但加堿再煮沸可促進其解離:[Co(NH3)5Cl]2+![]() Co3++5NH3+Cl。
Co3++5NH3+Cl。
c.H2O2參與反應時,明顯放熱。
請回答:
(1)制備配合物X的總反應方程式為___________。
(2)“1) NH4Cl-NH3H2O”時,如果不加NH4Cl固體,對制備過程的不利影響是____。
(3)“2)H2O2”加H2O2 時應選擇 _________(填序號)。
A.冷水浴 B.溫水浴( ≈60°C)
C.沸水浴 D.酒精燈直接加熱
(4)本實驗條件下,下列物質均可將 Co(II)氧化為 Co(III)。其中可替代“2)H2O2”的是_____________(填序號)。
A.O2 B.KMnO4 溶液 C.Cl2 D.HNO3
(5)實驗小組用以下思路驗證配合物 X 的組成:取一定量 X 加入過量濃 NaOH 溶液,煮沸,將生成的NH3 通入一定量的稀硫酸中,再用NaOH 標準溶液滴定剩余 H2SO4 。從以下涉及堿式滴定管的操作中,選擇正確操作并排序(潤洗只操作一次即可):

檢漏→水洗→加標準液,潤洗內壁→___________→_________→_________→_________→……
a.從上口倒出潤洗液
b.保持滴定管夾水平,平視滴定管刻度讀數
c.裝標準溶液,調液面,靜置半分鐘
d.滴定
e.取下滴定管,豎直,平視滴定管刻度讀數
f.從下口放出潤洗液
(6)下列關于實驗過程的敘述,正確的是_____________(填序號)。
A.“4)70℃”水浴加熱,有利于獲得顆粒較大的晶體
B.抽濾后,應該用熱水洗滌晶體
C.可用 AgNO3和稀HNO3 檢驗配合物X 是否已經洗凈
D.抽濾結束,可先打開活塞K,再關掉抽氣泵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)某反應中反應物與生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一種未知物質X。(As為砷元素)
①已知KBrO3在反應中得到電子,則該反應的還原劑是____________________
②已知0.2mol KBrO3在反應中得到1mol電子生成X,則X的化學式為_____________
③根據上述反應可推知_______
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4> KBrO3
c.還原性:AsH3>X d.還原性:X > AsH3
(2)①向MnSO4和硫酸的混合溶液里加入K2S2O8(過二硫酸鉀),溶液會發如下反應:Mn2++S2O82-+H2O→MnO4-+SO42-+H+,該反應常用于檢驗Mn2+的存在。其特征現象是_________________,若反應中有0.1 mol還原劑參加反應,則消耗氧化劑的物質的量為__________
②將NaBiO3固體(黃色微溶)加入到MnSO4和H2SO4的混合溶液里加熱,固體溶解變為澄清溶液,發生如下反應:NaBiO3+MnSO4+H2SO4→Na2SO4+Bi2(SO4)3+NaMnO4+H2O,配平上述反應的化學方程式,并用雙線橋標出電子轉移的方向和數目__________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是1mol金屬鎂和鹵素反應的ΔH(單位:kJ·molˉ1)示意圖,反應物和生成物均為常溫時的穩定狀態。下列選項中不正確的是
A.電解MgCl2制Mg是吸熱反應
B.MgBr2與Cl2反應的ΔH<0
C.MgF2(s)+Br2(l) = MgBr2(s)+F2(g) ΔH=+600kJ·molˉ1
D.化合物的熱穩定性順序:MgI2>MgBr2>MgCl2>MgF2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知熱化學方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反應,最終放出的熱量為( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反應,最終放出的熱量為( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組的同學對氯氣與鐵的反應及產物進行了如下探究:
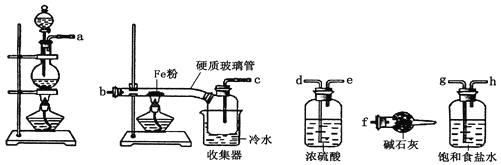
(1) 裝置的連接順序為a→_____→____→____→____→b→c→f。
(2) 硬質玻璃管中可觀察到的現象是___________________;硬質玻璃管與收集器之間沒有用導管連接,原因是____________________;反應一段時間、熄滅酒精燈,冷卻后,將收集器及硬質玻璃管中物質快速轉移至錐形瓶中,加入過量的稀鹽酸和少許植物油(反應過程中不振蕩),充分反應后,進行如下實驗:

(3) 試劑X的化學式為___________;有同學分析淡黃色溶液中含有Fe2+,你認為_______(填“合理”或“不合理”);固體產物的成分可能為__________(填相應的字母);
A Fe和FeCl3 B FeCl2和FeCl3 C Fe、FeCl2和FeCl3 D Fe和FeCl2
(4) 加入少許植物油的作用是___________________,用離子方程式表示加入新制氯水后溶液紅色加深的原因_______________________________。
(5) 某小組同學實驗時在加入新制氯水后,并未得到深紅色溶液,請幫助他們分析原因________,請設計實驗對你所分析的原因進行驗證,簡要寫出實驗方案___________
(6)Cl2是一種黃綠色有刺激性氣味的氣體,實驗室通常用NaOH溶液來吸收Cl2,以減少環境污染。若實驗時需要450mL 4mol/L的NaOH溶液,則配制時,需要用托盤天平稱取NaOH的質量為_______g,所使用的儀器除托盤天平、膠頭滴管、玻璃棒外,還必須有_________。配制該溶液時,下列操作會使溶液濃度偏高的是___________。(填字母)
A 稱量固體時動作緩慢 B 容量瓶未干燥立即用來配制溶液
C NaOH固體溶解后立刻轉移 D 在容量瓶中定容時俯視容量瓶刻度線
E 定容后搖勻,發現液面降低,又補加少量水,重新達到刻度線
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com