
 研究和深度開發CO、CO2的應用對構建生態文明社會具有重要的意義.
研究和深度開發CO、CO2的應用對構建生態文明社會具有重要的意義.| 容 器 | 甲 | 乙 |
| 反應物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
分析 (1)①Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1②C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1由蓋斯定律①-②×3計算得到;
(2)CO燃料電池中,負極上是CO發生失電子的氧化反應,正極上是氧氣發生得電子的還原反應,又因為電解質是KOH溶液,不會在電極上放出二氧化碳;
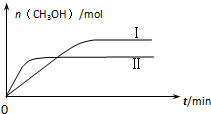
(3)①II平衡時間小于I,說明II反應速率大于I,且平衡時II中CH3OH的物質的量小于I,說明平衡向逆反應方向移動,則只能是升高溫度,溫度越高,化學平衡常數越小;
②根據平衡三部曲求出甲中平衡時各氣體的物質的量,然后根據平衡后乙與甲中相同組分的體積分數相等,且起始時維持反應逆向進行來判斷范圍;
③達到反應平衡狀態時,在一定條件下的可逆反應里,正反應速率和逆反應速率相等,反應混合物中各組成成分的百分含量保持不變,該反應就達到平衡狀態,據此分析解答.
解答 解:(1)①Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1②C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1由蓋斯定律①-②×3得到Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,
故答案為:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1;
(2)烷燃料電池以KOH溶液為電解質溶液時,負極上是CO發生失電子的氧化反應,又因為電解質是KOH溶液,二氧化碳和氫氧化鉀反應得到的是碳酸鉀,即CO+4OH--2e-=CO32-+2H2O,
故答案為:CO+4OH--2e-=CO32-+2H2O;
(3)①II平衡時間小于I,說明II反應速率大于I,且平衡時II中CH3OH的物質的量小于I,說明平衡向逆反應方向移動,則只能是升高溫度,即II的溫度大于I,溫度越高,平衡向逆反應方向移動,導致化學平衡常數越小,所以KⅠ>KⅡ,
故答案為:>;
②設二氧化碳反應量為x
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始量(mol):1 3 0 0
轉化量(mol):x 3x x x
平衡量(mol):1-x 3-3x x x
甲中平衡后氣體的壓強為開始時的0.8倍,即$\frac{4-2x}{4}$=0.8
解得x=0.4mol
依題意:甲、乙為等同平衡,且起始時維持反應逆向進行,所以全部由生成物投料,c的物質的量為1mol,c 的物質的量不能低于平衡時的物質的量0.4mol,所以c的物質的量為:0.4<n(c)≤1mol,
故答案為:0.4<n(c)≤1.
③a、在恒壓容器中進行,壓強一直不變,所以不能判斷達到了平衡狀態,故錯誤;
b、H2的體積分數不變,則正逆反應速率相等,表明反應達到平衡狀態,故正確;
c.c(H2)=3c(CH3OH),與反應物開始的量和轉化率有關,則不能判斷達到了平衡狀態,故錯誤;
d.反應前后質量不變,但體積一直在變,所以容器中密度不變,表明反應達到平衡狀態,故正確;
e.2個C=O斷裂的同時有6個H-H斷裂,都是指正反應方向,所以不能判斷達到了平衡狀態,故錯誤;
故選:bd.
點評 本題主要考查了化學反應常數、化學平衡以及原電池原理的運用,難度不大,根據所學知識即可完成.


科目:高中化學 來源: 題型:選擇題
| 容器 | 甲 | 乙 |
| 反應物投入量 | 3molFe、2molCO2 | 4molFeO、3molCO |
| CO的濃度/mol•L-1 | c1 | c2 |
| CO2 的體積分數 | V1 | V2 |
| 體系的壓強(Pa) | p1 | p2 |
| 氣態反應物的轉化率 | α1 | α2 |
| A. | 2c1=3c2 | B. | V1=V2 | C. | p1=p2 | D. | α1=α2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 開始時A容器中的反應速率大于B容器中的反應速率 | |
| B. | 平衡時c(I2)A=c(I2)B | |
| C. | HI的平衡分解率:αA>αB | |
| D. | 平衡時,I2蒸氣在混合氣體中的體積分數:A容器>B容器 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3OH (l)+$\frac{3}{2}$O2 (g)═CO2(g)+2H2O(l)△H=+726.5 kJ/mol | |
| B. | 2CH3OH (l)+3O2 (g)═2CO2(g)+4H2O(g)△H=+1453 kJ/mol | |
| C. | CH3OH (l)+$\frac{3}{2}$O2 (g)═CO2(g)+2H2O(l)△H=-726.5 kJ/mol | |
| D. | 2CH3OH (l)+3O2 (g)═2CO2(g)+4H2O(g)△H=-1453 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 有一種甲醇質子交換膜燃料電池,電池的結構示意圖如圖,則下列有關說法不正確的是( )
有一種甲醇質子交換膜燃料電池,電池的結構示意圖如圖,則下列有關說法不正確的是( )| A. | 電極c是電池的負極 | |
| B. | 每消耗1mol甲醇轉移的電子數為3NA | |
| C. | 電極d的反應式為:4H++O2+4e-=2H2O | |
| D. | 電極c的反應式為:CH3OH+H2O-6e-=CO2+6H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(CO)=1.6 mol•(L•min)-1 | B. | v(NO2)=0.9 mol•(L•min)-1 | ||
| C. | v(N2)=0.25mol•(L•min)-1 | D. | v(CO2)=1.2 mol•(L•min)-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗編號 | HA物質的量濃度(mol•L-1) | NaOH物質的量濃度(mol•L-1) | 混合溶液的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com