
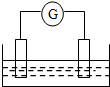
 如圖是常見原電池裝置,電流表G發生偏轉:
如圖是常見原電池裝置,電流表G發生偏轉:分析 (1)銅鋅原電池中,活潑金屬作負極,在正極上有氣體生成;若電解質為硫酸銅溶液,則在正極上析出銅;
(2)根據反應“2FeCl3+Fe=3FeCl2”可知,反應中鐵失電子而被氧化,應為原電池負極,Fe3+在正極得到電子而被還原,電解質溶液為FeCl3,依次分析解答;
(3)Mg、Al兩種金屬做電極,若電解質溶液是稀硫酸,Mg失電子是負極;若電解質溶液換作稀氫氧化鈉溶液,Al失電子是負極.
解答 解:(1)將Zn棒和Cu棒用導線連接后,若電解質溶液為稀硫酸,則鋅為負極,銅為正極,負極反應為Zn-2e-=Zn2+,正極反應為:2H++2e-=H2↑,在正極上有氣體生成;將Zn棒和Cu棒用導線連接后,若電解質為硫酸銅溶液,則在正極上析出銅,鋅為負極,負極反應為Zn-2e-=Zn2+,正極反應為Cu2++2e-=Cu,
故答案為:2H++2e-=H2↑;Cu2++2e-=Cu;
(2)由反應“2FeCl3+Fe=3FeCl2”可知,反應中鐵失電子而被氧化,應為原電池負極,負極上鐵失電子發生氧化反應,正極上鐵離子得電子發生還原反應,其電極反應式為:負極為Cu-2e-=Cu2+,正極為2Fe3++2e-=2Fe2+,
故答案為:Fe;Fe-2e-=Fe2+;
(3)Mg、Al兩種金屬做電極,若電解質溶液是稀硫酸,Mg失電子是負極,電極反應式為:Mg-2e-=Mg2+;若電解質溶液換作稀氫氧化鈉溶液,Al失電子是負極,Mg為正極,正反應的離子方程式為:2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案為:Mg-2e-=Mg2+;正極;2Al+2H2O+2OH-=2AlO2-+3H2↑.
點評 本題考查原電池的設計及原電池的工作原理、電極反應式書寫,題目難度不大,利用基礎知識可以解答.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 此裝置可以實現Cl2的制取、收集、尾氣吸收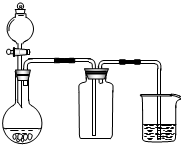 | |
| B. | 此裝置可以實現乙酸乙酯的制取和收集 | |
| C. | 此裝置可以形成Cu-Zn原電池 | |
| D. | 此裝置可證明H2CO3酸性大于H2SiO3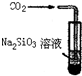 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,8 g O2含有電子數目為4NA | |
| B. | 1 L 0.1mol/L的氯化銨溶液中NH4+的數目為0.1NA | |
| C. | 常溫常壓下,22.4L氯氣與足量的鎂粉反應,轉移的電子數為2NA | |
| D. | 含1mol FeCl3的飽和溶液滴入沸騰蒸餾水中,所得紅褐色液體中含膠粒數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無色的堿性溶液中:CrO42-、K+、Na+、SO42- | |
| B. | 使pH試紙變紅的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、H+、I-、SO42- | |
| D. | 水電離產生的c(H+)=10-12mol•L-1的溶液中:Na+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
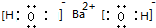 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com