
【題目】現有金屬單質A、B、C和氣體甲、乙、丙及物質D、E、F、G、H,它們之間能發生如下反應(圖中有些反應的產物和反應的條件沒有全部標出)。
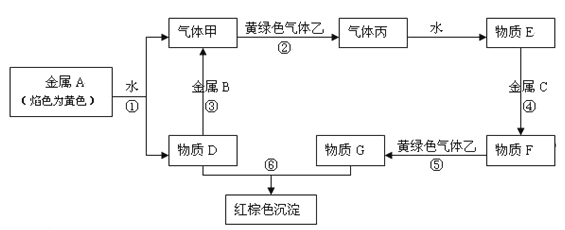
請根據以上信息回答下列問題:
(1)寫出金屬元素A的原子結構示意圖:_______________。
(2)寫出下列反應的離子方程式:
反應③___________;反應⑤____________________
(3)檢驗物質G中陽離子的操作方法_____________________。
(4)實驗室制取黃綠色氣體乙的化學方程式為__________________,在該反應中如有0.5 mol乙生成,轉移的電子的物質的量是_____mol。制取完畢,多余的乙將用D的水溶液來吸收,其離子方程式為____________________。
【答案】 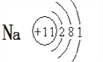 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Fe2++Cl2=2Fe3++2Cl- 取物質G少許于試管中,向其中滴加少量的KSCN溶液,溶液變為血紅色(或紅色),證明物質G中有Fe3+離子。 MnO2+4HCl(濃)
2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Fe2++Cl2=2Fe3++2Cl- 取物質G少許于試管中,向其中滴加少量的KSCN溶液,溶液變為血紅色(或紅色),證明物質G中有Fe3+離子。 MnO2+4HCl(濃) ![]() MnCl2+Cl2↑+2H2O 1 Cl2+2OH =Cl+ClO+H2O
MnCl2+Cl2↑+2H2O 1 Cl2+2OH =Cl+ClO+H2O
【解析】金屬A焰色反應為黃色,故A為金屬Na,由反應①可知,D為NaOH,氣體甲為H2;氫氧化鈉與金屬B反應生成氫氣,故金屬B為Al.黃綠色氣體乙為Cl2,與氫氣反應生成丙為HCl,HCl溶于水得物質E為鹽酸.氫氧化鈉與物質G反應生成紅褐色沉淀是Fe(OH)3,故物質G中含有Fe3+,E與金屬C反應生成F,F與氯氣反應生成G,可推知C為Fe,F為FeCl2,G為FeCl3,
(1)金屬元素Na的核電荷數11,其原子結構示意圖為![]() ;
;
(2)反應③是金屬Al溶解于NaOH溶液生成氫氣,發生反應的離子方程式為2Al+2OH-+2H2O=2AlO2-+3H2↑;反應⑤是在氯化亞鐵溶液中通氯氣,將Fe2+氧化為Fe3+,發生反應的離子方程式為2Fe2++Cl2=2Fe3++2Cl-;
(3)檢驗FeCl3溶液中Fe3+的方法是取FeCl3少許于試管中,向其中滴加少量的KSCN溶液,溶液變為血紅色(或紅色),證明FeCl3中有Fe3+離子;
(4)實驗室用二氧化錳和濃鹽酸混合加熱制取氯氣,發生反應的化學方程式為MnO2+4HCl(濃) ![]() MnCl2+Cl2↑+2H2O,在該反應中如有0.5 mol氯氣生成,轉移的電子的物質的量是1mol。制取完畢,多余的Cl2對環境有污染,需用NaOH的水溶液來吸收,其離子方程式為 Cl2+2OH =Cl+ClO+H2O。
MnCl2+Cl2↑+2H2O,在該反應中如有0.5 mol氯氣生成,轉移的電子的物質的量是1mol。制取完畢,多余的Cl2對環境有污染,需用NaOH的水溶液來吸收,其離子方程式為 Cl2+2OH =Cl+ClO+H2O。


 紅果子三級測試卷系列答案
紅果子三級測試卷系列答案 課堂練加測系列答案
課堂練加測系列答案科目:高中化學 來源: 題型:
【題目】“低碳生活”是指減少能源消耗、節約資源,從而減少二氧化碳排放的生活方式。下列不符合“低碳生活”的做法是
A.節能燈代替白熾燈 B.太陽能熱水器代替燃氣熱水器
C.紙巾代替棉手帕 D.環保袋代替一次性塑料袋
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知常溫下,Ksp[Fe(OH)3]=4.0×10-38, 在FeCl3溶液中加入NaHCO3溶液產生沉淀和氣體,反應的離子方程式為:____________;若將所得懸濁液的pH調整為4,則溶液中Fe3+濃度為_________molL-1
(2)常溫下,濃度均為0.1molL-1的下列五種鈉鹽溶液的PH如下表
溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
PH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述鹽溶液中的陰離子,結合H+能力最強的是__________。根據表中數據,濃度均為0.01 molL-1的下列四種酸的溶液分別稀釋100倍,PH變化最大的是___________(填編號)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(3) 下列說法不正確的是___ ___ ___ (填序號)
A.某溫度下純水中的c(H+)=10-6,故顯酸性
B.用稀鹽酸洗滌AgCl沉淀比用水洗滌損耗AgCl小
C.相同溫度下,0.1mol/LNH4Cl溶液中NH4+的濃度比0.1mol/L氨水中NH4+的濃度大
D.相同溫度下,PH均為8的Na2CO3和NaHCO3溶液,前者物質的量濃度大
E.向飽和石灰水中加入CaO固體,溶液中Ca2+、OH-的物質的量均減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)如圖所示的裝置在實驗室中用途比較廣泛:

①排空氣法收集氣體,若收集CO2氣體,進氣口為_______ (填“a”或“b”)。
②若瓶中裝滿水,可用于收集下列氣體中的_________(選填編號)。
A、NO B、NO2 C、NH3 D、HCl
此時進氣口為____________(填“a”或“b”)。
③如果廣口瓶中盛放濃硫酸,可用作氣體干燥裝置,則該裝置不可以干燥的氣體有____________(選填編號)。
A、HCl B、NH3 C、H2 D、CO
④此裝置還可用于除去氣體中的雜質氣體。若要用此裝置除去CO2中混有的少量SO2氣體,則裝置中應盛放的液體可能是____________(選填編號)。
A、NaOH溶液 B、飽和Na2CO3溶液 C、飽和NaHCO3溶液 D、濃H2SO4
(2)下面是中學化學實驗中常見的幾種儀器:
A.量筒 B.容量瓶 C.試管 D.圓底燒瓶 E.托盤天平
①其中儀器上要標出使用溫度的是_____________(填選項)
②可用作反應容器并能進行加熱的是___________(填選項)
③下列操作,使得實驗結果偏小的是____________(填選項)
A.稱取5.2 gNaCl固體時,將砝碼放在左盤,NaCl固體放在右盤
B.配制一定物質的量濃度的NaCl溶液,轉移NaCl溶液前,容量瓶中已有少許蒸餾水
C. 配制一定物質的量濃度的NaCl溶液,定容時俯視讀數。
D.用量筒量取一定體積的濃硫酸,濃硫酸倒入燒杯后,用蒸餾水繼續沖洗量筒內壁并將洗滌液倒入燒杯。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活密切相關,下列有關說法錯誤的是
A. 使用含有氯化鈣的融雪劑會加快橋梁的腐蝕
B. 納米鐵粉通過物理吸附可除去污水中的Pt2+、Cu2+、Cd2+、Hg2+等
C. 用合成聚碳酸酯可降解塑料,實現碳的循環利用
D. 近期在北方出現的霧霾是一種分散系,戴活性炭口罩的原理是吸附作用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將小塊生石灰投入盛有水的試管中,發生劇烈反應。一段時間后,用手觸摸試管外壁感覺燙手,這個實驗事實說明該反應
A. 是放熱反應 B. 是吸熱反應
C. 反應過程中熱能轉化為化學能 D. 反應物的總能量等于生成物的總能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵酸鉀(K2FeO4,4FeO42-+10H2O=4Fe(OH)3(膠體)+3O2↑+8OH-)是一種新型的自來水處理劑,它的性質和作用是( )
A.有強氧化性,可消毒殺菌,還原產物能吸附水中雜質
B.有強還原性,可消毒殺菌,氧化產物能吸附水中雜質
C.有強氧化性,能吸附水中雜質,還原產物能消毒殺菌
D.有強還原性,能吸附水中雜質,氧化產物能消毒殺菌
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鈦對人體體液無毒且有惰性,能與肌肉和骨骼生成在一起,故有“生命金屬”之稱。下列有關4822Ti和5022Ti的說法正確的是
A. 質量數相同,互為同位素
B. 質子數相同,互為同位素
C. 中子數相同,屬同一種元素的不同核素
D. 核外電子數相同,中子數不同,不能互稱為同位素
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com