
【題目】氫氟酸是一種弱酸,可用來刻蝕玻璃,已知25℃時:
HF(aq) + OH—(aq)![]() F—(aq) + H2O(l) △H=-67.7 kJ/mol
F—(aq) + H2O(l) △H=-67.7 kJ/mol
H+(aq) + OH—(aq)![]() H2O(l) △H=-57.3kJ/mol
H2O(l) △H=-57.3kJ/mol
在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 濃度為c mol/L的HF稀溶液,下列說法中錯誤的是
A. 當氫氟酸溶液溫度升高,HF的電離程度減小(不考慮揮發)
B. 水電離的熱化學方程式為:H2O(1)![]() H+(aq)+OH—(aq);△H= +57.3kJ/mol
H+(aq)+OH—(aq);△H= +57.3kJ/mol
C. 當c > 0.1時,一定不存在:c(Na+) = c(F—)
D. 若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),則c一定小于0.1
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】清潔能源氫氣制取與儲存是氫能源利用領域的研究熱點.
已知:①CH4(g)+ H2O(g)![]() CO(g)+3H2(g) △H =+206.2kJ·mol-1
CO(g)+3H2(g) △H =+206.2kJ·mol-1
②CH4(g)+ CO2(g)![]() 2CO(g)+2H2(g) △H =+247.4kJ·mol-1
2CO(g)+2H2(g) △H =+247.4kJ·mol-1
③2H2S(g)![]() 2H2(g)+S2(g) △H =+169.8kJ·mol-1
2H2(g)+S2(g) △H =+169.8kJ·mol-1
請按要求回答下列問題
(1)以甲烷為原料制取氫氣是工業上常用的制氫方法.CH4與H2O(g)反應生成CO2(g)和H2(g)的熱化學方程式為________________.
(2)在密閉容器中充入一定量的H2S,發生反應③。如圖所示為H2S氣體的平衡轉化率與溫度、壓強的關系。
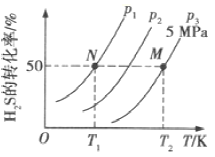
①圖中壓強(P1、P2、P3)的大小順序為______,該反應平衡常數的大小關系為K(T1)_____填(“>”“<”或“=”)K(T2)。
②如果想進一步提高H2S的轉化率,除改變溫度、壓強外,還可以采取的措施有_________。
(3)硫化氫是劇毒氣體,尾氣中硫化氫有多種處理方法:
①堿溶液吸收。用150 ml 2.0 mol![]() L-1的NaOH溶液吸收4480 mL(標準狀況)H2S得到吸收液X(顯堿性)。X溶液中離子濃度的大小關系正確的是_____(填選項字母)。
L-1的NaOH溶液吸收4480 mL(標準狀況)H2S得到吸收液X(顯堿性)。X溶液中離子濃度的大小關系正確的是_____(填選項字母)。
A.c()c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)
B.c(Na+)+c(H+)=c(OH-)+ c(HS-)+ c(S2-)
C.2c(Na+)=3[c(H2S)+c(HS-)+ c(S2-)]
D.c(OH-)= c(H+)+ c(HS-)+2 c(H2S)
②純堿溶液吸收,寫出該吸收法發生反應的離子方程式_________________________。已知H2CO3和H2S在25℃時的電離常數如表所示:

③硫酸銅溶液吸收。200mL0.05 mol/ L的CuSO4溶液吸收液中H2S,恰好使反應溶液中Cu2+和S2-濃度相等的溶液中c(Cu2+)為___________________(已知常溫下,Ksp(CuS)≈1.0×10-36)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗現象與實驗結論或原理不一致的是
選項 | 實驗現象 | 實驗結論或原理 |
A | 生活中用泡沫滅火器滅火 | 3HCO3-+Al3+===Al(OH)3↓+3CO2↑ |
B | 向AgCl懸濁液中滴入少量KI溶液,有黃色沉淀生成 | 說明KSP(AgCl)>KSP(AgI) |
C | 向NaHS溶液中滴入酚酞,溶液變紅色 | HS-水解程度大于電離程度 |
D | Na2CO3溶液中滴加酚酞呈紅色 | CO32-+2H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2017年采用中國自主知識產權的全球首套煤基乙醇工業化項目投產成功。某地煤制乙醇的過程表示如下。
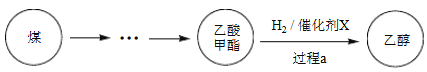
(1)Cu(NO3)2是制備“催化劑X”的重要試劑。

① 氣體A是_______。
② 實驗室用Cu(NO3)2固體配制溶液,常加入少量稀HNO3。運用化學平衡原理簡述HNO3的作用_______。
③ NaClO溶液吸收氣體A的離子方程式是_______。
(2)過程a包括以下3個主要反應:
Ⅰ.CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) ΔH1
C2H5OH(g)+CH3OH(g) ΔH1
Ⅱ.CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5 (g)+CH3OH(g) ΔH2
CH3COOC2H5 (g)+CH3OH(g) ΔH2
Ⅲ.CH3COOCH3(g)+H2(g)![]() CH3CHO(g)+CH3OH(g) ΔH3
CH3CHO(g)+CH3OH(g) ΔH3
相同時間內,測得CH3COOCH3轉化率、乙醇和乙酸乙酯的選擇性(如乙醇選擇性= ![]() )如下圖所示。
)如下圖所示。
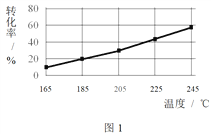
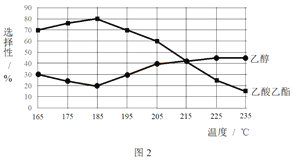
① 已知:ΔH1 < 0。隨溫度降低,反應Ⅰ化學平衡常數的變化趨勢是_______。
② 下列說法不合理的是________。
A.溫度可影響反應的選擇性
B.225℃~235℃,反應Ⅰ處于平衡狀態
C.增大H2的濃度,可以提高CH3COOCH3的轉化率
③ 為防止“反應Ⅲ”發生,反應溫度應控制的范圍是_______。
④ 在185℃下,CH3COOCH3起始物質的量為5 mol,生成乙醇的物質的量是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SO2廣泛用于醫藥、硫酸工業等領域,回收廢氣中的SO2可用如下方法。
方法Ⅰ | 用堿式硫酸鋁Al2(SO4)x(OH)y溶液吸收富集SO2 |
方法Ⅱ | 在Fe2+或Fe3+催化下,用空氣(O2)將SO2氧化為H2SO4 |
(1)方法Ⅰ的過程如下。
① 制備Al2(SO4)x(OH)y
向Al2(SO4)3溶液中加入CaO粉末,調pH至3.6。 CaO的作用之一是促進_______水解(填離子符號,下同),二是沉淀一部分_______。
② 吸收:Al2(SO4)x(OH)y吸收SO2后的產物是_______(寫化學式)。
③ 解吸:加熱②中產物,產生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化學方程式是______。
(3)方法Ⅱ中,Fe2+的催化過程可表示如下:
ⅰ:2 Fe2++ SO2+ O2=2 Fe3++ SO42-
ⅱ: ……
① 寫出ⅱ的離子方程式:______。
② 下列實驗方案可證實上述催化過程。將實驗方案補充完整。
a.向FeCl2溶液滴入KSCN,無變化
b.向FeCl2溶液通入少量SO2,滴入KSCN,顏色變紅。
c.取b中溶液,_______。
(4)方法Ⅱ中,催化氧化后,采用滴定法測定廢氣中殘留SO2的含量。將V L(已換算為標準狀況)廢氣中的SO2用1%的H2O2完全吸收,吸收液用下圖所示裝置滴定,共消耗a mL c mol/L NaOH標準液。
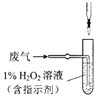
① H2O2氧化SO2的化學方程式_______。
② 廢氣中殘留SO2的體積分數為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組設計不同實驗方案比較Cu2+、Ag+ 的氧化性。
(1)方案1:通過置換反應比較
向酸化的AgNO3溶液插入銅絲,析出黑色固體,溶液變藍。反應的離子方程式是_______,說明氧化性Ag+>Cu2+。
(2)方案2:通過Cu2+、Ag+ 分別與同一物質反應進行比較
實驗 | 試劑 | 編號及現象 | |
試管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.產生黃色沉淀,溶液無色 |
1.0 mol/L CuSO4溶液 | Ⅱ.產生白色沉淀A,溶液變黃 | ||
① 經檢驗,Ⅰ中溶液不含I2,黃色沉淀是________。
② 經檢驗,Ⅱ中溶液含I2。推測Cu2+做氧化劑,白色沉淀A是CuI。確認A的實驗如下:
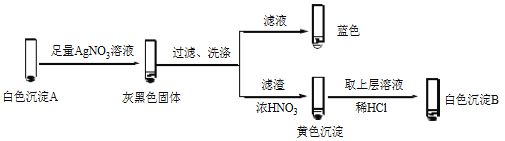
a.檢驗濾液無I2。溶液呈藍色說明溶液含有________(填離子符號)。
b.白色沉淀B是________。
c.白色沉淀A與AgNO3溶液反應的離子方程式是____,說明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,設計實驗如下:
編號 | 實驗1 | 實驗2 | 實驗3 |
實驗 |
|
|
|
現象 | 無明顯變化 | a中溶液較快變棕黃色,b中電極 上析出銀;電流計指針偏轉 | c中溶液較慢變淺黃色; 電流計指針偏轉 |
(電極均為石墨,溶液濃度均為 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黃色的原因是_______(用電極反應式表示)。
② “實驗3”不能說明Cu2+氧化了I-。依據是空氣中的氧氣也有氧化作用,設計實驗證實了該依據,實驗方案及現象是_______。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:_______。
(資料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將二氧化硫通入到氯化鋇溶液中未見到明顯現象,把上述溶液分為兩份,其中一份a加入NaOH溶液,另一份b中通入Cl2 , 均有白色沉淀產生,其中a中沉淀的化學式為 , b中沉淀的化學式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,A、B兩個裝置中的燒杯分別盛有足量的CuCl2溶液。

(1)A、B、C三個裝置中屬于原電池的是________(填標號,下同),屬于電解池的是_____________
(2)A池中Zn是_____極,電極反應式為________;Cu是______極,電極反應式為______________,A中總反應的方程式為________________________。
(3)B池中總反應的方程式為________________。
(4)C池中Zn是____極,電極反應式為_____;Cu是______極,電極反應式為____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com