
| A. | 因為反應物濃度越大,反應速率越快,所以常溫下,相同的鋁片中分別加入足量的濃、稀硝酸,濃硝酸中鋁片先溶解完 | |
| B. | 增大反應物濃度可加快反應速度,因此用濃硫酸與鐵反應能增大生成H2的速率 | |
| C. | 對化學反應速率起決定性作用的因素是參加反應的各物質的性質 | |
| D. | 化學反應速率也可以用單位時間內固體物質的消耗量或者氣體物質的生成量來表示 |
分析 A.濃硝酸和鋁發生鈍化現象;
B.濃硫酸和鐵發生鈍化現象,且濃硫酸和鐵反應不生成氫氣;
C.化學反應速率取決于物質本身的性質;
D.化學反應速率常用單位時間內任何一種反應物物質的量濃度的減小或生成物物質的量濃度的增加來表示.
解答 解:A.常溫下,濃硝酸和Al發生鈍化現象阻止進一步反應,所以稀硝酸中鋁片先溶解完,故A錯誤;
B.常溫下,濃硫酸和鐵發生鈍化現象而阻止進一步反應,且濃硫酸和Fe反應生成SO2而不是H2,故B錯誤;
C.化學反應速率取決于物質本身的性質,外界條件只是影響因素,故C正確;
D.化學反應速率常用單位時間內任何一種反應物物質的量濃度的減小或生成物物質的量濃度的增加來表示,固體和純液體沒有濃度而言,故D錯誤;
故選C.
點評 本題考查化學反應速率影響因素,濃度、溫度、催化劑、壓強(僅適用于有氣體參加的反應)等都影響反應速率,但不是反應速率快慢的決定因素,易錯選項是AB.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
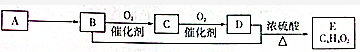
| A. | B中含有的官能團為羥基 | B. | 可用碳酸鈉溶液區別B、D | ||
| C. | D中含有C═O鍵,E的名稱為乙酸乙酯 | D. | B+D→E反應的裝置如圖 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯的硝化、乙烯使高錳酸鉀酸性溶液褪色的反應都屬于取代反應 | |
| B. | 蛋白質、淀粉、油脂等都能在人體內水解并提供能量 | |
| C. | 乙烯、苯、乙烷分子中的所有原子都在同一平面上 | |
| D. | 石油裂解的主要目的是提高汽油等輕質油的產量與質量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等氣態短鏈烴 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 亞氯酸鈉(NaClO2)是一種重要的含氯消毒劑,主要用于水的消毒以及砂糖、油脂的漂白與殺菌.如圖是過氧化氫法生產亞氯酸鈉的工藝流程圖:
亞氯酸鈉(NaClO2)是一種重要的含氯消毒劑,主要用于水的消毒以及砂糖、油脂的漂白與殺菌.如圖是過氧化氫法生產亞氯酸鈉的工藝流程圖:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. Al(OH)3+3H+(用離子方程式表示).
Al(OH)3+3H+(用離子方程式表示).| X | ||||
| Y | Z | W |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com