
【題目】第四周期元素在生產生活中具有重要的作用。請回答下列問題:
(1)基態Sc原子的價電子排布圖為___________________。
(2)Zn2+和CN-、K+可組成化合物K2Zn(CN)4,其中存在的化學鍵類型有____________;Zn(CN)42-中的配體為_______,配位原子為_____ ,與該配離子中配體等電子體的分子為___。
(3)與Br同主族的短周期元素有F、Cl,這三種元素的簡單氫化物HF、HCl、HBr的沸點從高到低的順序為___________,理由為______。
(4)Fe-Cr-Al合金可作為汽車尾氣催化劑的載體,汽車尾氣催化劑可將NO2還原為無毒害的氣體,防止HNO3型酸雨的形成,NO2的空間構型為_____。HNO3的酸性強于HNO2的原因為____________________。
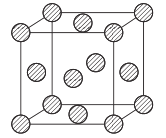
(5)金屬銅采用面心立方堆積方式,其晶胞結構如圖所示。已知該晶胞的密度為ρg. cm-3,晶胞參數為anm,阿伏伽德羅常數為NA,則銅原子的相對原子質量的表達式為_______(用含有ρ、a、NA的表達式表示)。
【答案】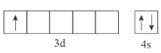 離子鍵、共價鍵、配位鍵 CN- C N2或CO HF>HBr>HCl HF、HCl、HBr均為分子晶體,HF分子之間存在氫鍵,因此HF的沸點最高,HCl和HBr的相對分子質量大,故HBr的沸點高于HCl; V型 HNO3中N的化合價為+5價,其N的正電性強于HNO2中N,使羥基中O-H鍵的共用電子對更易偏向O原子,羥基更易電離出H+,故酸性HNO3強于HNO2
離子鍵、共價鍵、配位鍵 CN- C N2或CO HF>HBr>HCl HF、HCl、HBr均為分子晶體,HF分子之間存在氫鍵,因此HF的沸點最高,HCl和HBr的相對分子質量大,故HBr的沸點高于HCl; V型 HNO3中N的化合價為+5價,其N的正電性強于HNO2中N,使羥基中O-H鍵的共用電子對更易偏向O原子,羥基更易電離出H+,故酸性HNO3強于HNO2 ![]()
【解析】
(1)Sc原子序數是21號元素,屬于過渡元素,價電子排布式為3d14s2,然后書寫出價電子排布圖;
(2)該化合物屬于配合物,內界和外界以離子鍵形式結合,然后按照配合物組成進行分析;
(3)分子晶體熔沸點高低的判斷,從是否含有分子間氫鍵、相對分子質量大小角度進行分析;
(4)利用VSEPR模型進行分析;利用含氧酸酸性強弱規律進行分析;
(5)利用密度的定義進行分析計算;
(1) Sc原子序數是21號元素,屬于過渡元素,價電子排布式為3d14s2,Sc價電子排布式圖為 ;
;
(2)K2Zn(CN)4中K+和Zn(CN)42-之間存在離子鍵,Zn2+和CN-之間構成配位鍵,CN-中C和N之間存在共價鍵,因此該配合物中含有化學鍵的類型為離子鍵、配位鍵、共價鍵;Zn2+提供空軌道,CN-中C提供孤電子對,因此配體為CN-,配位原子為C;根據等電子體的定義,與CN-等電子體的分子為N2、CO等;
(3)HF、HCl、HBr都屬于分子晶體,HF含有分子間氫鍵,HCl、HBr不含分子間氫鍵,HBr的相對分子質量大于HCl,HBr的分子間作用力大于HCl,因此沸點大小順序是HF>HBr>HCl;
(4)NO2中含有2個σ鍵,孤電子對數=![]() =0.5,可以認為中心原子N的價層電子對數為3,NO2的空間構型為V型;HNO3中N的化合價為+5價,其N的正電性強于HNO2中N,使羥基中O-H鍵的共用電子對更易偏向O原子,羥基更易電離出H+,故酸性HNO3強于HNO2;
=0.5,可以認為中心原子N的價層電子對數為3,NO2的空間構型為V型;HNO3中N的化合價為+5價,其N的正電性強于HNO2中N,使羥基中O-H鍵的共用電子對更易偏向O原子,羥基更易電離出H+,故酸性HNO3強于HNO2;
(5)根據晶胞的結構,Cu原子位于頂點和面心,個數為![]() =4,晶胞的質量為
=4,晶胞的質量為![]() g·mol-1,晶胞的體積為(a×10-7)3cm3,根據密度的定義,
g·mol-1,晶胞的體積為(a×10-7)3cm3,根據密度的定義,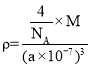 ,推出M=
,推出M=![]() 。
。


科目:高中化學 來源: 題型:
【題目】在兩個恒容的密閉容器中進行下列兩個可逆反應:
甲:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
現有下列狀態:①混合氣體平均相對分子質量不再改變
②恒溫時,氣體壓強不再改變 ③各氣體組成濃度相等
④反應體系中溫度保持不變 ⑤斷裂氫氧鍵速率是斷裂氫氫鍵速率的2倍 ⑥混合氣體密度不變 ⑦單位時間內,消耗水蒸氣質量與生成氫氣質量比為9∶1
其中能表明甲、乙容器中反應都達到平衡狀態的是( )
A. ①②⑤ B. ③④⑥ C. ⑥⑦ D. ④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用 H2 和鈉反應制備氫化鈉的裝置如右圖所示(Zn 粒中含有少量 ZnS 雜質),下列說法不正確的是

A. ①、 ②中依次盛有濃 NaOH 溶液、 濃 H2SO4
B. 管式爐加熱前, 用試管收集③處氣體并點燃, 通過聲音判斷氣體純度
C. 結束反應時, 先停止管式爐加熱, 再關閉活塞 K
D. 取出瓷舟內的固體, 投入適量水中, 若有氣體產生, 即可證明制得了氫化鈉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫條件下,用0.100 mol/L的NaOH溶液分別滴定酸HX、HY、HZ,三種酸的體積均為20.00 mL,濃度均為0.100 mol/L,滴定曲線如圖所示。下列敘述正確的是
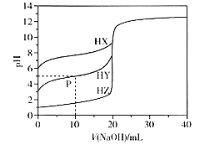
A.電離常數Ka(HX)的數量級為10-12
B.P點對應的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
C.pH=7時,三種溶液中c(X-) =c(Y-)=c(Z-)
D.HX的電離程度大于X-的水解程度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近日,我國科學家實現了CO2的捕獲與轉化,裝置如圖所示,利用其能吸收二氧化碳,并產生有價值的物質,該設計在國際期刊《JournalofEnergyChemistry》中發表。下列有關說法正確的是( )
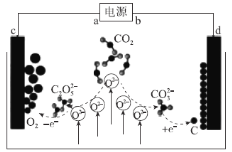
A.電源在使用過程中,b極發生還原反應
B.該裝置實現了CO2的化學能轉化為電能
C.利用該裝置的原理,理論上也可用于捕獲與轉化硫氧化物、氮氧化物
D.若電源中有4mol電子轉移,則最多可捕獲CO222.4L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】黃血鹽[亞鐵氰化鉀K4Fe(CN)6]目前廣泛用作食品添加劑(抗結劑),我國衛生部規定實驗中黃血鹽的最大使用量為10 mg/kg,一種制備黃血鹽的工藝如下:
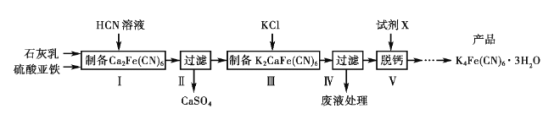
請回答下列問題:
(1)過濾需要用到的玻璃儀器有__________;寫出中間產物CaSO4的一種用途__________。
(2)步驟I反應的化學方程式是___________。
(3)步驟V所用的試劑X是________(填化學式),在得到產品前還需經過的步驟包括____。
(4)工藝中用到劇毒的HCN溶液,含CN-等的廢水必須處理后才能排放。
①CN-的電子式是_____________。
②處理含CN-廢水的方法:第一步NaClO溶液先將CN-不完全氧化為OCN-;第二步NaClO溶液完全氧化OCN-生成N2和兩種鹽。第二步反應的離子方程式是_____。
(5)已知反應:
3Fe2++2[Fe(CN)6]3- =Fe3[Fe(CN)6]2↓(藍色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(藍色沉淀)
現有Fe2+被氧化后的溶液,僅供選擇的試劑:鐵粉、鐵氰化鉀溶液、亞鐵氰化鉀溶液、KSCN溶液,請設計檢驗Fe2+是否氧化完全的實驗方案_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
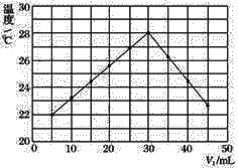
【題目】某研究小組將V1mL 1.0 mol·L-1HCl溶液和V2mL未知濃度的NaOH溶液混合均勻后測量并記錄溶液溫度,實驗結果如圖所示(實驗中始終保持V1+V2=50 mL)。回答下列問題:
(1)研究小組做該實驗時環境溫度________(填“高于”、“低于”或“等于”)22℃,判斷的依據是_______。
(2)由題干及圖形可知:V1∶V2=________時,酸堿恰好完全中和,此反應所用NaOH溶液的濃度應為______ mol·L-1。
(3)實驗時將酸堿在簡易量熱計中混合,并用_______攪拌,使溶液混合均勻。經計算此反應共放出Q kJ的熱量,請寫出表示中和熱的熱化學方程式:________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
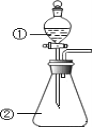
A.節日里燃放的五彩繽紛的煙花是某些金屬元素化學性質的展現
B.用坩堝鉗夾住一小塊用砂紙仔細打磨過的鋁箔在酒精燈上加熱,熔化后的液態鋁滴落下來, 說明金屬鋁的熔點較低
C.將等物質的量的氧化鈉和過氧化鈉分別投入到足量且等質量的水中,得到溶質質量分數分別是 a%和 b%的兩種溶液,則a 和 b 的關系是 a=b
D.用如圖裝置進行實驗,將裝置①中的 AlCl3 溶液滴入裝置②濃氫氧化鈉溶液,開始滴加時就可觀察到有白色沉淀產生
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質中含氧原子的物質的量一定相同的是
A. 3.36L O2 和 0.3 mol H2O
B. 0.1 mol H2SO4 和 3.6 g H2O
C. 0.1 mol FeSO4·7H2O 和 0.1 mol C12H22O11(蔗糖)
D. 6.02×1023 個 CO2 與 0.1 mol KMnO4
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com