
【題目】下表是元素周期表的一部分,表中所列的字母分別代表一種元素。
A | R | |||||||||||||||||
B | C | D | E | F | T | |||||||||||||
G | H | I | J | K | L | |||||||||||||
M | N | O | ||||||||||||||||
試回答下列問題(注意:每問中的字母代號為上表中的字母代號,并非為元素符號)
(1)N的單質和水蒸氣反應能生成固體X,則I的單質與X高溫下反應的化學方程式______。
(2)D的簡單氣態氫化物的VSEPR模型的名稱為______。
(3)由A、C、D形成的ACD分子中,σ鍵和π鍵個數=______。
(4)元素M的化合物(ME2L2)在有機合成中可作氧化劑或氯化劑,能與許多有機物反應。回答問題:
①ME2L2常溫下為深紅色液體,能與CCl4、CS2等互溶,據此可判斷ME2L2是______(填“極性”或“非極性”)分子。
②將N和O的單質用導線連接后插入D的最高價氧化物對應的水化物濃溶液中,可制成原電池,則組成負極材料的元素的外圍電子軌道表示式為______。
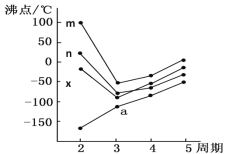
(5)如圖四條折線分別表示ⅣA族、Ⅴ/span>A族、ⅥA族、ⅦA族元素氣態氫化物沸點變化,則E的氫化物所在的折線是______(填m、n、x或y)。
【答案】8Al+3Fe3O4![]() 4Al2O3+9Fe 四面體 1:1 非極性
4Al2O3+9Fe 四面體 1:1 非極性 ![]() m
m
【解析】
A為H,R為He,B為Li,C為C,D為N,E為O,F為F,T為Ne,G為Na,H為Mg,I為Al,J為Si,K為S,L為Cl,M為Cr,N為Fe,O力Cu,據此解答。
(1)Fe的單質和水蒸汽反應能生成固體Fe3O4,則Al與Fe3O4反應生成Fe和Al2O3,其化學方程式8Al+3Fe3O4![]() 4Al2O3+9Fe,故答案為:8Al+3Fe3O4
4Al2O3+9Fe,故答案為:8Al+3Fe3O4![]() 4Al2O3+9Fe;
4Al2O3+9Fe;
(2)D的氣態氫化物NH3,價層電子對數為4,VSEPR模型的名稱為四面體,故案為:四面體;
(3)由A、C、D形成的ACD分子HCN,其結構為H-C≡N,σ鍵和π鍵個數比為1:1,故答案為:1:1;
(4)①ME2L2常溫下為深紅色液體,能與CCl4、CS2等互溶,CCl4、CS2是非極性分子,根據相似相溶原理得出ME2L2是非極性分子,故答案為:非極性;
②將N和O的單質用導線連接后插入D的最高價氧化物對應的水化物濃溶液中,可制成Cu-Al-濃硝酸原電池,則組成負極材料是銅,其外圍電子軌道表達式為![]() ,故本題答案為:
,故本題答案為:![]() ;
;
(5)如圖四條折線分別表示ⅣA族、VA族、ⅥA族ⅦA族元素氣態氫化物沸點變化,沸點最高的是H2O,因比m為H2O,n為HF,x為NH3,y為CH4,則E的氫化物為H2O,其所在的折線是m,故答案為:m。


科目:高中化學 來源: 題型:
【題目】M、X、Y、Z為4種原子序數依次增大的短周期主族元素,其原子序數之和為22。已知M、Y形成的化合物使濕潤的紅色石蕊試紙變藍色,M、Z形成化合物的水溶液可以蝕刻玻璃,4種元素形成某種化合物的結構式為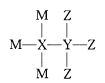 。下列說法正確的是
。下列說法正確的是
A.X、Y均不屬于第ⅣA族元素
B.原子半徑:Y>X>Z>M
C.M與Y、Z三種元素只能形成共價化合物
D.該化合物中每種原子的最外層都達到了8電子穩定結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰電池應用廣泛,大致可分為鋰金屬電池和鋰離子電池。鋰離子電池工作原理:以石墨/鋰鈷氧電池為例,其總反應方程式為:LiCoO2+6C![]() Li1-xCoO2+LixC6
Li1-xCoO2+LixC6
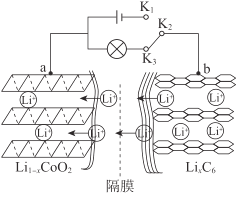
試回答下列問題:
(1)連接K1、K2時,a作___極。
(2)連接K2、K3時,被還原的物質是___。
(3)放電時,負極發生反應的電極反應式是___。
(4)鋰離子電池的電極廢料(含LiCoO2)中的金屬可回收利用。
①將電極廢料磨碎后用酸浸出,磨碎的目的是___。
②將電極廢料用鹽酸浸出,得到含Li+、Co2+的溶液,并有黃綠色氣體生成,則該反應的化學方程式是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙酸丁酯的物理性質如表。
乙酸 | 1-丁醇 | 乙酸丁酯 | |
熔點(℃) | 16.6 | -89.5 | -73.5 |
沸點(℃) | 117.9 | 117 | 126.3 |
密度(g/cm3) | 1.05 | 0.81 | 0.88 |
水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
實驗室用如圖所示的實驗裝置制取乙酸丁酯。
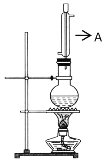
(1)儀器A的名稱___。
(2)寫出制取乙酸丁酯的化學方程式:__。
(3)該實驗中生成物除了主產物乙酸丁酯外,還可能生成的有機副產物有__(寫出一種結構簡式)。
(4)酯化反應是一個可逆反應,為提高1-丁醇的轉化率,可采取的措施是__(寫出兩條)。
(5)從制備乙酸丁酯所得的混合物中分離、提純乙酸丁酯時,需要經過多步操作,下列圖示的操作中,需要的是__(填答案編號)。
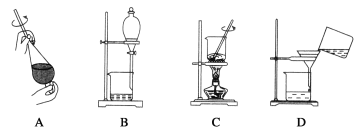
(6)用60g乙酸與37g1-丁醇反應,實驗中得到乙酸丁酯的質量為40.6g,則乙酸丁酯的產率為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有4種物質:碳酸氫鈉、硫酸鋇、燒堿、苯。(以下必須填寫化學式)
(1)屬于堿的是________________;
(2)屬于硫酸鹽的是________________;
(3)屬于酸式鹽的是________________;
(4)屬于有機物的是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三氯氫硅(SiHCl3)是制備硅烷、多晶硅的重要原料,在催化劑作用下可發生反應:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K時SiHCl3的轉化率隨時間變化的結果如圖所示。
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K時SiHCl3的轉化率隨時間變化的結果如圖所示。

下列敘述不正確的是
A.該反應為吸熱反應
B.反應速率大小:va >vb
C.70 ℃時,平衡常數K =0.112/0.782
D.增大壓強,可以提高SiHCl3的平衡轉化率,縮短達平衡的時間
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業以軟錳礦(主要成分是MnO2,含有SiO2、Fe2O3等少量雜質)為主要原料制備高性能的磁性材料碳酸錳(MnCO3)。其工業流程如圖:
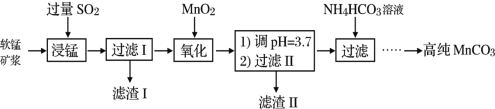
(1)為了提高“浸錳”過程中原料的浸出率,可以采取的措施有___(寫一條。)
(2)浸錳過程中Fe2O3與SO2反應的化學方程式為:Fe2O3+SO2+2H+=2Fe2++SO![]() +H2O,該反應是經歷以下兩步反應實現的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。寫出ⅱ的離子方程式___。
+H2O,該反應是經歷以下兩步反應實現的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。寫出ⅱ的離子方程式___。
(3)過濾Ⅰ所得濾液中主要存在的兩種金屬陽離子為___(填離子符號)。
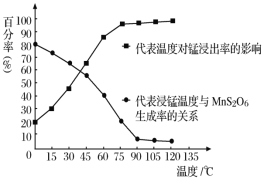
(4)“浸錳”反應中往往有副產物MnS2O6生成,溫度對“浸錳”反應的影響如圖所示,為減少MnS2O6的生成,“浸錳”的適宜溫度是___。
(5)寫出“氧化”過程中MnO2與SO2反應的化學方程式___。
(6)濾渣Ⅱ是___(填化學式)。
(7)向過濾Ⅱ所得的濾液中加入NH4HCO3溶液時溫度不宜太高的原因是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某固體粉末X中可能含有K2SO4、(NH4)2CO3、K2SO3、NaNO3、Cu2O、FeO、Fe2O3中的若干種。某同學為確定該固體粉末的成分,取X進行如下實驗,實驗過程及現象如圖所示。該同學得出的結論不正確的是( )

已知:Cu2O+2H+=Cu2++Cu+H2O
A.根據現象1無法推出固體粉末中是否含有NaNO3
B.根據現象2可推出白色沉淀是BaSO4
C.根據現象3可推出固體粉末中一定含有K2SO3
D.根據現象4可推出固體粉末中的氧化物只有FeO
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com