
【題目】鉻化學豐富多彩,由于鉻光澤度好,常將鉻鍍在其他金屬表面,同鐵、鎳組成各 種性能的不銹鋼,CrO3大量地用于電鍍工業中. 
(1)在如圖裝置中,觀察到圖 1 裝置銅電極上產生大量的無色氣泡,而圖 2 裝置中銅電 極上無氣體產生,鉻電極上產生大量有色氣體.
圖 2 裝置中鉻電極的電極反應式
(2)最近贛州酒駕檢查特別嚴,利用 CrO3 具有強氧化性,有機物(如酒精)遇到 CrO3 時,猛烈反應,CrO3 被還原成綠色的硫酸鉻[Cr2(SO4)3],另該過程中乙醇被氧化成乙酸,從而增強導電性,根據電流大小可自動換算出酒精含量.寫出該反應的化學方程式為 .
(3)雖然鉻加到鐵中可將鐵做成不銹鋼可減少金屬腐蝕,但 生產成本高,生活中很多情況下還是直接使用鋼鐵,但易腐蝕,利用右圖裝置 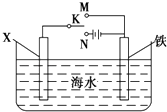 ,可以模擬鐵的電化學防護.若 X 為碳棒,為減緩鐵的腐蝕,開關 K 應置于處.若 X 為鋅,開關K 置于處.
,可以模擬鐵的電化學防護.若 X 為碳棒,為減緩鐵的腐蝕,開關 K 應置于處.若 X 為鋅,開關K 置于處.
(4)CrO3 和 K2Cr2O7 均易溶于水,這是工業上造成鉻污染的主要原因.凈化處理方法之一是將含+6 價 Cr 的廢水放入電解槽內,用鐵作陽極,加入適量的 NaCl 進行電解:陽極區生成的 Fe2+和 Cr2O72﹣發生反應,生成的 Fe3+和 Cr3+在陰極 區與OH﹣結合生成 Fe(OH)3和 Cr(OH)3 沉淀除去,已知某條件下的KspFe(OH)3=3.0×10﹣31 , KspCr(OH)3=6.0×10﹣38 . 已知電解后的溶液中 c(Fe3+)為 2.0×10﹣6 molL1 , 則溶液中 c(Cr3+)=molL﹣1 .
【答案】
(1)NO3﹣+4H++3e﹣=NO↑+2H2O
(2)4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O
(3)N;N或M
(4)4.0×10﹣13
【解析】解:(1)圖1裝置銅電極上產生大量的無色氣泡,說明Cr的活潑性大于Cu,而圖 2裝置中銅電極上無氣體產生,鉻電極上產生大量有色氣體,說明Cr為正極、Cu為負極,則Cr和硝酸能產生鈍化現象,正極上硝酸根離子得電子發生還原反應生成NO,電極反應式為:NO3﹣+4H++3e﹣=NO↑+2H2O,
所以答案是:NO3﹣+4H++3e﹣=NO↑+2H2O;
(2.)由題目信息可知,CrO3、C2H5OH、H2SO4反應生Cr2(SO4)3、CH3COOH,同時還有水生成,反應方程式為:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O,
所以答案是:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O;
(3.)若 X 為碳棒,開關 K 應置于M處,構成原電池,Fe為負極,加速Fe的腐蝕,開關 K 應置于N處,構成原電池,Fe為陰極,被保護,減緩鐵的腐蝕,
若 X 為鋅,開關 K 應置于M處,構成原電池,Zn為負極,Fe被保護,減緩鐵的腐蝕,開關 K 應置于N處,構成原電池,Fe為陰極,被保護,減緩鐵的腐蝕,
所以答案是:N;N或M;(4)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH﹣)=2.0×10﹣6×c3(OH﹣)=3.0×10﹣31 ,
Ksp[Cr(OH)3]=c(Cr3+)×c3(OH﹣)=6.0×10﹣38
聯立可得c(Cr3+)=4.0×10﹣13mol/L,
所以答案是:4.0×10﹣13 .


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】常溫下,0.1mol/L CH3COONa溶液pH=9,則下列說法正確的是( )
A.加入少量NaOH固體后溶液pH小于9
B.加水稀釋,CH3COONa水解程度增大,c(OH﹣)增大
C.該溶液水電離出的c(OH﹣)═10﹣9
D.CH3COOH在常溫下Ka數值約為1×10﹣5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究氮氧化物與懸浮在大氣中海鹽粒子的相互作用時,同溫度下涉及如下反應:
a、2NO(g)+Cl2(g)2ClNO(g)△H1<0 其平衡常數為K1
b、2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)△H2<0 其平衡常數為K2
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)△H3的平衡常數K=(用K1、K2表示).△H3=(用△H1、△H2表示).
(2)為研究不同條件對反應a的影響,在恒溫條件下,向2L恒容密閉容器中加入0.2mol NO和0.1mol Cl2 , 10min時反應a達到平衡.測得10min內V(ClNO)=7.5×10﹣3molL﹣1min﹣1 , 則平衡后n(Cl2)=mol,NO的轉化率α1= . 其它條件保持不變,反應(1)在恒壓條件下進行,平衡時NO的轉化率為α2 , α1α2(填“>”“<”或“=”),平衡常數K1(填“增大”“減小”或“不變”).若要使K1減小,可采用的措施是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,甲池的總反應式為 2CH3OH+3O2+4KOH═2K2CO3+6H2O.下列說法正確的 是( ) 
A.若將乙池電解液換成 AgNO3 溶液,則可以實現在石墨棒上鍍銀
B.甲池通入 CH3OH 的電極反應式為 CH3OH+6e﹣+2H2O═CO32﹣+8H+
C.反應一段時間后,向乙池中加入一定量 Cu(OH)2 固體,能使 CuSO4溶液恢復到 原濃度
D.甲池中消耗 224mL(標準狀況下)O2 , 此時丙池中理論上產生 1.16g 固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】液體燃料電池相比于氣體燃料電池具有體積小等優點.一種以液態肼(N2H4)為燃料 的電池裝置如圖所示,該電池以空氣中的氧氣為氧化劑,以 KOH 溶液為電解質溶液.下列 關于該電池的敘述錯誤的是( ) 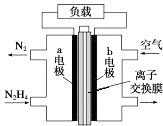
A.b 極發生還原反應
B.a 極的反應式為 N2H4﹣4e﹣═N2↑+4H+
C.放電時,電流從 b 極經過負載流向 a 極
D.其中的離子交換膜需選用陰離子交換膜
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個容積可變的密閉容器中發生反應:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)。
Fe3O4(s)+4H2(g)。
回答下列問題:
(1)增加Fe的量,正反應速率 (填“增大”、“減小”或“不變”,下同)。
(2)將容器的容積縮小一半,正反應速率 ,逆反應速率 。
(3)保持容器的容積不變,充入N2使體系壓強增大,正反應速率 ,逆反應速率 。
(4)保持壓強不變,充入N2使容器的容積增大,正反應速率 ,逆反應速率 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,濃度均為0.1molL﹣1、體積均為100mL的兩種一元酸HX、HY的溶液中,分別加入NaOH固體,lg ![]() 隨加入NaOH的物質的量的變化如圖所示.下列敘述正確的是( )
隨加入NaOH的物質的量的變化如圖所示.下列敘述正確的是( ) 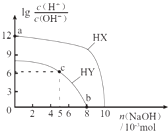
A.HX的酸性弱于HY
B.a點由水電離出的c(H+)=10﹣12 molL﹣1
C.c點溶液中:c(Y﹣)>c(HY)
D.b點時酸堿恰好完全反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關碳及其化合物的敘述中錯誤的是
A.12C、13C、14C互為同位素
B.金剛石和石墨互為同素異形體
C.石墨轉化為金剛石屬于化學變化
D.向空氣中排放二氧化碳會形成酸雨
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于蒸餾操作的說法不正確的是
A. 燒瓶內放碎瓷片的目的是防止暴沸
B. 燒瓶不能直接加熱,應墊上石棉網
C. 實驗時發現燒瓶中沒有放碎瓷片,應停止加熱,馬上加入
D. 在點燃酒精燈加熱前,應先通冷卻水
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com