
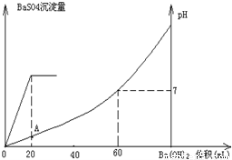
向20mL鹽酸和硫酸的混合酸溶液中,漸漸加入
0.1mol/L的Ba(OH)2溶液。生成沉淀的質量和溶液的pH變化曲線如右圖。根據此實驗數據計算:
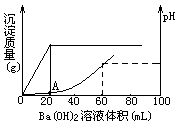
(1)原溶液中硫酸和鹽酸的濃度各為多少_________________。
(2)A點處溶液的pH是______________。
(1)c(H2SO4)=0.1mol/L c(HCl)=0.4mol/L
(2) pH=0.7
本題以圖示形式檢查酸、堿中和生成沉淀質量和溶液pH曲線隨加入Ba(OH)2溶液體積變化情況,此題屬于理解層次的中等難度試題。
(1)依據圖示,沉淀最大時已加入Ba(OH)2溶液20mL,混合酸中硫酸被完全中和。所以原混合酸中硫酸的物質的量濃度為0.1mol/L。
當H2SO4剛被Ba(OH)2溶液中和時,可以認為溶液中鹽酸未被中和。從20mL起,再加Ba(OH)2溶液至60mL時溶液中鹽酸全被中和完,溶液呈中性,pH=7,所以原混合酸中鹽酸的物質的量濃度為0.4mol/L。
(2)A點處溶液中氫離子濃度是鹽酸提供的,因H2SO4剛被Ba(OH)2溶液中和,溶液被沖稀,體積擴大到原來的2倍,則鹽酸濃度縮小到原來的1/2,由原來的0.4mol/L變為0.2mol/L。即氫離子濃度為0.2mol/L。所以pH=0.7。


 黃岡小狀元解決問題天天練系列答案
黃岡小狀元解決問題天天練系列答案 三點一測快樂周計劃系列答案
三點一測快樂周計劃系列答案科目:高中化學 來源: 題型:閱讀理解
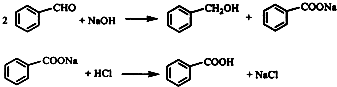


查看答案和解析>>
科目:高中化學 來源: 題型:
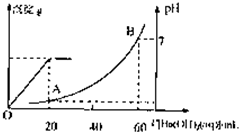 室溫時,鹽酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液時,生成的BaSO4和pH的變化如圖所示(不考慮溶液混合時體積的變化).下列說法正確的是( )
室溫時,鹽酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液時,生成的BaSO4和pH的變化如圖所示(不考慮溶液混合時體積的變化).下列說法正確的是( )| A、圖中A點溶液的pH=1 | B、生成沉淀的最大質量為2.33g | C、原混合溶液中鹽酸物質的量濃度為0.1mol/L | D、當V[Ba(OH)2(aq)]=10mL時,發生反應的離子方程式為:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年湖北省武漢市高三二月調研測試理科綜合化學試卷(解析版) 題型:選擇題
室溫時,鹽酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液時,生成的BaSO4和pH的變化如圖所示(不考慮溶液混合時體積的變化)。下列說法正確的是
A.圖中A點溶液的pH=1
B.生成沉淀的最大質量為2.33g
C.原混合溶液中鹽酸物質的量濃度為0.1mol/L
D.當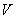 [Ba(OH)2(aq)]=10mL時,發生反應的離子方程式為:Ba2++SO
[Ba(OH)2(aq)]=10mL時,發生反應的離子方程式為:Ba2++SO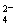 ═BaSO4↓
═BaSO4↓
查看答案和解析>>
科目:高中化學 來源: 題型:
向20mL 鹽酸和硫酸的混合溶液中,逐滴加入 0.1mol/L的 Ba(OH)2 溶液,沉淀的質量和溶液的pH值與加入的 Ba(OH)2 溶液體積的圖像如下圖所示(注意:起點時混酸的pH不為0)。回答:

(1)起始時,混合酸中硫酸的物質的量濃度是________mol/L,鹽酸的物質的量濃度________mol/L。
(2)B點時沉淀的質量約是________g,
(3)A點時溶液中c(H+)為______mol/L;
(4)當酸堿恰好中和時,溶液中c(SO42-)為 mol/L。
已知Ksp(BaSO4)=1.1×10-10。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com