
【題目】下圖為阿托酸甲酯的一種合成路線:
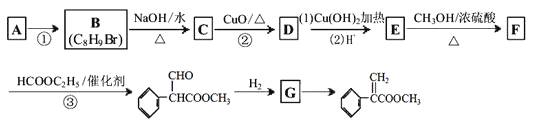
已知:反應③為取代反應,另一反應產物為乙醇
請回答下列問題:
(1)已知A為芳香烴,其核磁共振氫譜中出現5個蜂,其面積比為1:1:2:2:2,則A的名稱為___________,若要檢驗有機物B的官能團,則所使用的試劑除了有機物B和水之外,還需要的試劑有________、________、________(填化學式)。
(2)寫出有關的化學方程式
反應②____________________;
反應③____________________。
(3)阿托酸甲酯所含官能團的名稱為____________________;阿托酸甲酯有多種同分異構體,其中苯環上只有一個支鏈,既能與NaHCO3溶液反應,又能使溴的四氯化碳溶液褪色的同分異構體有__________種(不考慮立體異構)。
(4)阿托酸甲酯的另外一種合成路線如下圖所示:
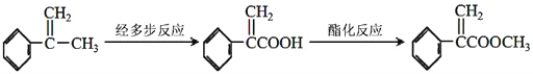
已知在多步反應過程中進行了下列4種不同的反應類型,請按照實際進行的反應順序依次寫出這四種反應類型的字母序號__________。
a.取代反應 b.消去反應 c.加成反應 d.氧化反應
【答案】苯乙烯NaOH溶液稀HNO3AgNO3溶液![]()
![]() 碳碳雙鍵、酯基8cadb
碳碳雙鍵、酯基8cadb
【解析】A為芳香烴,結合B的分子式可知,A為苯乙烯或乙苯、二甲苯,A的核磁共振氫譜中出現5個峰,其面積比為1:1:2:2:2,則A為![]() ,與溴化氫發生加成反應生成B,B發生鹵代烴的水解反應生成C,C可以連續發生氧化反應,則B為
,與溴化氫發生加成反應生成B,B發生鹵代烴的水解反應生成C,C可以連續發生氧化反應,則B為![]() ,C為
,C為![]() ,D為
,D為![]() ,E為
,E為![]() .苯乙酸與乙醇發生取代反應生成F為
.苯乙酸與乙醇發生取代反應生成F為![]() ,F與甲酸甲酯發生取代反應生成
,F與甲酸甲酯發生取代反應生成![]() ,
,![]() 與氫氣發生加成反應生成G為
與氫氣發生加成反應生成G為![]() ,G再發生消去反應得阿托酸乙酯;
,G再發生消去反應得阿托酸乙酯;
(1)由上述分析可知,A為![]() ,名稱為苯乙烯,B為
,名稱為苯乙烯,B為![]() ,含有的官能團為溴原子,檢驗溴原子方法為:將鹵代烴在NaOH水溶液、加熱條件水解得到NaBr,再用稀硝酸酸化,最后加入硝酸銀溶液,有淡黃色沉淀生成;
,含有的官能團為溴原子,檢驗溴原子方法為:將鹵代烴在NaOH水溶液、加熱條件水解得到NaBr,再用稀硝酸酸化,最后加入硝酸銀溶液,有淡黃色沉淀生成;
(2)反應②的化學方程式為:![]() ;反應③的化學方程式為:
;反應③的化學方程式為:![]() ;
;
(3)由阿托酸甲酯的結構可知,所含官能團有:酯基、碳碳雙鍵;阿托酸甲酯有多種同分異構體,其中苯環上只有一個支鏈,能與NaHCO3溶液反應,含有-COOH,又能使溴的四氯化碳溶液褪色,含有碳碳雙鍵,可以苯環取代烯酸烴基中H原子得到,烯酸有:CH2=CHCH2COOH,CH3CH=CHCOOH,CH2=C(CH3)COOH,烴基分別有3、3、2種H原子,故符合條件的同分異構體共有8種;
(4)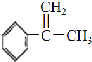 與溴發生加成反應得到
與溴發生加成反應得到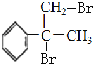 ,在在氫氧化鈉水溶液、加熱條件下發生水解反應得到
,在在氫氧化鈉水溶液、加熱條件下發生水解反應得到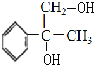 ,再發生氧化反應得到
,再發生氧化反應得到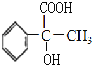 ,最后發生消去反應得到
,最后發生消去反應得到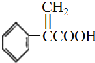 ,故答案為cadb。
,故答案為cadb。


 小題狂做系列答案
小題狂做系列答案科目:高中化學 來源: 題型:
【題目】短周期元素W、X、Y、Z的原子序數依次增大,W的單質是空氣中體 積分數最大的氣體,W與Y最外層電子數之和為X最外層電子數的2倍,X、Y、Z簡單離子的電子層結構相同,Z最外層電子數等于最內層電子數。下列說法正確的是
A. 單質Z可用海水作原料獲得
B. W的簡單氣態氫化物比Y的簡單氣態氫化物穩定
C. 原子半徑由大到小的順序:Z、Y、X、W
D. WX與ZX中的化學鍵類型相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把元素周期表中第16號元素和第6號元素的原子相比較,下列數據中前者是后者的4倍的是( )
A.電子數
B.最外層電子數
C.中子數
D.次外層電子數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】粗碘中通常含ICl和IBr,稱為鹵素互化物,其性質和鹵素單質相似,都是較強的氧化劑,而且受熱時ICl和IBr皆可像I2一樣升華,在粗碘中加入以下選項中的一種物質后,再進行升華可制得精碘,應加入的物質是( )。
A. H2O B. Zn C. KI D. KCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列選項中能表示阿伏加德羅常數數值的是
A.1mol H+ 含有的電子數 B.標準狀況下,22.4L酒精所含的分子數
C.1.6 g CH4 含有的質子數 D.1L 1mol/L的硫酸鈉溶液所含的Na+ 數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是部分城市某日空氣質量日報:
城市 | 污染指數 | 首要污染物 | 空氣質量等級 | ||
SO2 | NO2 | PM10 | |||
A | 98 | 23 | 67 | SO2 | Ⅱ |
B | 47 | 29 | 35 | SO2 | Ⅰ |
C | 62 | 80 | 113 | PM10 | Ⅲ |
D | 52 | 76 | 59 | NO2 | Ⅰ |
(1) 由上表可知,空氣質量日報中涉及的污染物主要是____________和可吸入顆粒物(PM10)。
(2) 汽車尾氣則是城市大氣中氮氧化物的主要來源之一。治理方法之一是在汽車排氣管上加裝“催化轉化器”,使CO與NOx反應生成可參與大氣生態環境循環的無毒氣體,寫出反應方程式_______________________________________。
(3) SO2的排放是造成酸雨的主要因素。形成酸雨的原理之一可簡單表示如下:
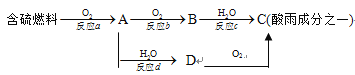
請回答下列問題:
①酸雨的pH____________(填“>”、“<”或“=”)5.6 ;
②反應b的化學方程式為____________________________________;
③在一段時間內連續不斷測定溶液D的pH值,發現pH值變小,表示該變化的化學方程式是_________________。
④若用足量的氫氧化鈉溶液吸收含二氧化硫的工業廢氣,寫出該反應的離子方程式______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液中一定能大量共存的是
A. ![]() 的溶液中:Na+、K+、SiO32—、SO32-
的溶液中:Na+、K+、SiO32—、SO32-
B. pH=1的溶液中:K+、Al3+、SO42-、F—
C. 與鎂反應生成氫氣的溶液中:Na+、Ba2+、NO3-、Cl-
D. 0.1mol/L的NaHCO3溶液中:NH4+、Mg2+、Br-、AlO2-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.自發進行的反應一定是放熱反應 B.非自發進行的反應一定是吸熱反應
C.自發進行的反應一定能發生 D.有些吸熱反應也能自發進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在一容積可變的容器中,反應2A(g)+B(g)![]() 2C(g)達到平衡時,A、B和C的物質的質量的量分別為4mol、2mol和4mol,保持溫度和壓強不變,對平衡混合物中三者的物質的量做如下調整,可使平衡右移的是( )
2C(g)達到平衡時,A、B和C的物質的質量的量分別為4mol、2mol和4mol,保持溫度和壓強不變,對平衡混合物中三者的物質的量做如下調整,可使平衡右移的是( )
A. 均減半 B. 均加倍 C. 均減少1mol D. 均增加1mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com