
| 溫度/K | 298 | 398 | 498 | … |
| 平衡常數(K) | 4.1×105 | K1 | K2 | … |
分析 (1)已知:①2NO(g)+3H2(g)?2NH3(g)+O2(g)△H1=-272.9kJ•mol-1,②2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1,②×3-①×2得到4NH3(g)+5O2(g)═4NO(g)+6H2O(g),根據蓋斯定律來計算即可;
(2)平衡常數隨溫度變化,與壓強和濃度變化無關,平衡常數變化結合反應一定原理分析判斷;
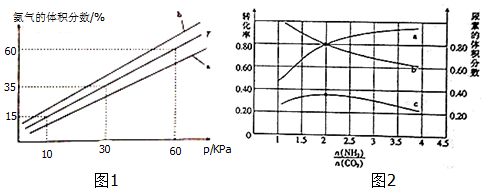
(3)A.由圖可知,溫度一定時,壓強增大氨氣的體積分數增大;
B.合成氨是放熱反應,壓強一定時,降低溫度平衡向正反應方向移動,平衡時氨氣的體積分數增大;
C.500℃溫度時反應速率加快及催化劑活性最好,正反應為放熱反應,溫度越低,氮氣的轉化率越高;
D.不同物質表示的正逆速率之比等于化學計量數之比,說明可逆反應到達平衡;
設參加反應的氮氣為n mol,則:
N2(g)+3H2(g)?2NH3(g)
開始(mol):10 40 0
轉化(mol):n 3n 2n
平衡(mol):10-n 40-3n 2n
根據平衡時氨氣的體積分數方程式計算n,進而計算氮氣的轉化率;
(4)由4NH3+5O2$\frac{\underline{催化劑}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3,可得:NH3+2O2=HNO3+H2O,根據方程計算;
(5)由圖可知,橫坐標為n(NH3):n(CO2)=2時,尿素的體積分數最大,氨氣的轉化率為80%,以此計算該條件下反應的平衡常數K.
解答 解:(1)已知:①2NO(g)+3H2(g)?2NH3(g)+O2(g)△H1=-272.9kJ•mol-1,②2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1,②×3-①×2得到4NH3(g)+5O2(g)═4NO(g)+6H2O(g),根據蓋斯定律△H3=3×(-483.6kJ•mol-1)-2×(-272.9kJ•mol-1)=-905.0KJ•mol-1,故答案為:-905.0KJ•mol-1;
(2)在一定體積的密閉容器中,進行如下化學反應:N2(g)+3H2(g)?2NH3(g)△H<0,反應是放熱反應,依據圖表數據分析,溫度升高,平衡逆向進行,平衡常數減小,K1>K2;故答案為:>;該反應為放熱反應,溫度升高,平衡逆向移動,平衡常數減小;
(3)①A.由圖可知,溫度一定時,壓強增大氨氣的體積分數增大,故A正確;
B.圖B中T=500℃,合成氨是放熱反應,壓強一定時,降低溫度平衡向正反應方向移動,平衡時氨氣的體積分數增大,則溫度為450℃時對應的曲線是b,故B正確;
C.500℃溫度時反應速率加快及催化劑活性最好,正反應為放熱反應,溫度越低氮氣的轉化率越高,高溫不利于氮氣的轉化,故C錯誤;
D.當 2v正(H2)=3v逆(NH3),不同物質表示的正逆速率之比等于化學計量數之比,說明可逆反應到達平衡,3v正(H2)=2v逆(NH3)時不能說明可逆反應到達平衡,故D錯誤;
故選:AB;
②設參加反應的氮氣為n mol,則:
N2(g)+3H2(g)?2NH3(g)
開始(mol):10 40 0
轉化(mol):n 3n 2n
平衡(mol):10-n 40-3n 2n
則$\frac{2n}{10-n+40-3n+2n}$×100%=25%,解得n=5,所以氮氣的轉化率為$\frac{5}{10}$×100%=50%,
故答案為:AB;50%;
(4)由4NH3+5O2$\frac{\underline{催化劑}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,則按理論上的原料比將原料放在一個具有反應條件的密閉容器中進行,所有物質不與外界交換,則生成1molHNO3、molH2O,則硝酸的質量分數為:$\frac{63}{63+18}$×100%=77.8%,
故答案為:77.8%;
(5)由圖可知,橫坐標為n(NH3):n(CO2)=2時,尿素的體積分數最大,且氨氣的轉化率為80%,
2NH3(g)+CO2(g)=CO(NH2)2(g)+H2O(g)
起始濃度(mol.L-1 ) 1 0.5 0 0
變化濃度(ol.L-1 ) 0.8 0.4 0.4 0.4
平衡濃度(mol.L-1 ) 0.2 0.1 0.4 0.4
該條件下反應的平衡常數K=$\frac{0.4×0.4}{0.1×0.{2}^{2}}$=40,
故答案為:2;40.
點評 本題考查了熱化學方程式和蓋斯定律的計算應用,化學反應能量變化圖象分析,平衡標志、平衡常數和平衡計算的判斷計算是解題關鍵,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 在任何溶液中,若有CaSO4沉淀析出,則c(Ca2+)與c(SO42-)一定相等 | |
| B. | d點溶液通過蒸發可以變到c點 | |
| C. | a點對應的Ksp等于c點對應的Ksp | |
| D. | b點將有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在25℃的蒸餾水中,FeS的溶解度最大 | |
| B. | 25℃時,CuS的飽和溶液中Cu2+的濃度約為1.14×10-18 mol•L-1 | |
| C. | 可用FeS固體作沉淀劑除去廢水中的Cu2+ | |
| D. | 向物質的量濃度相同的FeCl2、ZnCl2混合液中加入少量Na2S,只有FeS沉淀生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學式 | AgCl | Ag2CrO4 | CH3COOH | HC1O | H2CO3 |
| KSp 或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10 -5 | Ka=3.0×10-8 | Ka1=4.1×10一7 Ka2=5.6×10-11 |
| A. | 相同濃度CH3COONa和Na2CO3的混合液中,各離子濃度的關系有:c(Na+)>c(CO32- )>c(CH3COO- ) | |
| B. | 向0.1 mol•L-1 CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此時 c(CH3COOH):c(CH3COO-)=9:5 | |
| C. | 少量碳酸氫鈉固體加入到新制的氯水中,c(HC1O)增大 | |
| D. | 向濃度均為1×10-3 mol•L-1的KC1和K2CrO4混合液中滴加1×10-3 mol•L-1 的AgNO3溶液,CrO42-先形成沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
| H2O | CO | CO2 | CO | |||
| A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| C | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 僅①③⑤⑥ | B. | 僅③⑤⑥⑦ | C. | 僅⑤⑥⑦ | D. | 僅③④⑥⑦ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com