
【題目】某實驗小組以 H2O2 分解為例,研究濃度、催化劑、溶液酸堿性對反應速率的影響,在常溫下按照如下方案完成實驗。
實驗編號 | 反應物 | 催化劑 |
① | 10 mL 2% H2O2 溶液 | 無 |
② | 10 mL 5% H2O2 溶液 | 無 |
③ | 10 mL 5% H2O2 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
④ | 10 mL 5% H2O2 溶液+少量 HCl 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
⑤ | 10 mL 5% H2O2 溶液+少量 NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
(1)催化劑能加快化學反應速率的原因是_____。
(2)實驗①和②的目的是_________。實驗時由于較長時間沒有觀察到明顯現象而無法得出結論。資料顯示,通常條件下 H2O2 穩定,不易分解。為了達到實驗目的,你對原實驗方案的改進是_____。
(3)寫出實驗③的化學反應方程式:_____。
(4)實驗③、④、⑤中,測得生成氧氣的體積隨時間變化的關系如圖。分析如圖能夠得出的實驗結論是_____。

【答案】(1)降低了活化能(2分)
(2)探究濃度對反應速率的影響 (2分)
向反應物中加入等量同種催化劑(或將盛有反應物的試管放入同一熱水浴中)(2分)
(3)2H2O2![]() O2↑+2H2O(2分)
O2↑+2H2O(2分)
(4)堿性環境能增大H2O2分解的速率,酸性環境能減小H2O2分解的速率 (2分)
【解析】
(1)催化劑改變反應的途徑,降低反應所需的活化能,從而加快反應速率,故答案為:改變反應途徑,降低了活化能;
(2)實驗①和②的濃度不同,則該實驗的目的為探究濃度對化學反應速率的影響;為了便于比較,應在相同的條件下利用一個變量來比較,則向反應物中加入等量同種催化劑(或將盛有反應物的試管放在同一熱水浴中),故答案為:探究濃度對反應速率的影響;向反應物中加入等量同種催化劑(或將盛有反應物的試管放在同一熱水浴中);
(3)過氧化氫在催化劑作用下分解生成水和氧氣,該反應為2H2O2![]() 2H2O+O2↑,故答案為:2H2O2
2H2O+O2↑,故答案為:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(4)由圖可知,⑤的反應速率最大,④的反應速率最小,結合實驗方案可知,堿性環境能增大H2O2分解的速率,酸性環境能減小H2O2分解的速率,故答案為:堿性環境能增大H2O2分解的速率,酸性環境能減小H2O2分解的速率。


科目:高中化學 來源: 題型:
【題目】已知NO2和N2O4可以相互轉化:2NO2(g)![]() N2O4(g);ΔH<0。現將一定量NO2和N2O4的混合氣體通入體積為1L的恒溫密閉容器中,反應物濃度隨時間變化關系如下圖。下列說法中,正確的是
N2O4(g);ΔH<0。現將一定量NO2和N2O4的混合氣體通入體積為1L的恒溫密閉容器中,反應物濃度隨時間變化關系如下圖。下列說法中,正確的是

A.反應速率:v正(b點)<v正(d點)
B.前10min內用v(N2O4)表示的平均反應速率為0.04mol/(L·min)
C.25min時,導致平衡移動的原因是升高溫度
D.a和c點:Qc(濃度熵)<K(平衡常數)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是一種應用廣泛的鋰電池,LiPF6是電解質,SO(CH3)2是溶劑,電池反應為:4Li+FeS2=Fe+2Li2S。下列說法不正確的是
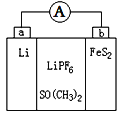
A. 該裝置將化學能轉化為電能
B. 可以用水代替 SO(CH3)2做溶劑
C. 電子移動方向是由a極經外電路流向b極
D. b極電極反應式是:FeS2+4Li++4e-=Fe+2Li2S
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)用Cl2生產某些含氯有機物時會產生副產物HCl。利用反應A,可實現氯的循環利用。反應A:![]()
已知:i. 反應A中,4mol HCl被氧化,放出115.6kJ的熱量。
ii.
![]()

①HCl的電子式是__________。
②反應A的熱化學方程式是____________。
③斷開1mol H-O鍵與斷開1mol H-Cl鍵所需能量相差約______kJ,H2O中H-O鍵比HCl中H-Cl鍵(填“強”或“弱”)_____。
(2)下圖是容積均為1L,分別按4種投料比[n(HCl):n(O2)]分別為1:1、2:1、4:1、6:1進行投料,反應溫度對HCl平衡轉化率影響的曲線。

①曲線c對應的投料比是__________。
②用平衡移動的原理解釋溫度和HCl平衡轉化率的關系__________。
③投料比為4:1、溫度為400℃時,平衡混合氣中Cl2的物質的量分數是_____,O2的平衡轉化率______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W是原子序數依次增大的短周期主族元素。Y的單質經常作為保護氣;由Z、W形成的一種化合物可與X、W形成的化合物反應,生成淡黃色固體。下列推斷正確的是
A. Y的最簡單氫化物的熱穩定性比Z的強
B. 在同周期元素中,W的最高價氧化物對應的水化物的酸性最強
C. 離子半徑:X<Y<Z<W
D. 含W的鹽溶液可能呈堿性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列反應:
① 2C(s)+O2(g)=2CO(g) △H1 = –221 kJ/mol
② CO(g)+1/2O2(g)=CO2 (g) △H2 = –283 kJ/mol
③ 稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H3 = –57.3 kJ/mol
請回答下列問題:
(1)碳(C)的燃燒熱為_______________________ 。已知碳的兩種同素異形體的轉化如下:C(s,金剛石) = C(s,石墨) △H = –1.9 kJ/mol ,則從能量角度判斷:穩定性更大的是_________________(填名稱)
(2)寫出能表達反應③意義的一個熱化學方程式_________________________________________________,向2L 0.5mol/L的NaOH溶液中加入稀醋酸,恰好完全反應時的熱效應為△H4 ,則△H3_________△H4(填“>”,“=”或“<”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知K、Ka、Kw、Kh、Ksp分別表示化學平衡常數、弱酸的電離平衡常數、水的離子積常數、鹽的水解平衡常數、難溶電解質的溶度積常數。
(1)25℃時,將a mol/L的氨水與0.01 mol/L的鹽酸等體積混合所得溶液中,c(NH4+)=c(Cl-)則溶液顯__________(填"酸""堿"或"中")性;用含a的代數式表示NH3·H2O的電離平衡常數Kb=__________;
(2)25℃,H2SO3![]() HSO3-+H+,其電離平衡常數Ka=1×10-2 mol/L,則該溫度下pH=3,c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=__________;
HSO3-+H+,其電離平衡常數Ka=1×10-2 mol/L,則該溫度下pH=3,c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=__________;
(3)高爐煉鐵中發生的反應有:FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH<0
Fe(s)+CO2(g) ΔH<0
①該反應的平衡常數表達式K=__________;
②已知1100℃時,K=0.25,則平衡時CO的轉化率為__________;
③在該溫度下,若測得高爐中c(CO2)=0.020mol/L,c(CO)=0.1 mol/L,則此時反應速率v正__________(填">""<"或"=")v逆
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com