

分析 孔雀石主要含Cu2(OH)2CO3,還含少量FeO、SiO2,向孔雀石中加入足量稀硫酸,發生的反應有Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑、FeO+H2SO4=FeSO4+H2O,SiO2和稀硫酸不反應,過濾得到固體SiO2,溶液A中含有含有亞鐵鹽及硫酸銅,氣體E為CO2,向溶液A中加入試劑①得到溶液B,試劑①是一種氧化劑,將Fe2+轉化為Fe3+且不能引進雜質,可選取雙氧水,向溶液B中加入CuO調節PH值使三價鐵離子沉淀,過濾得到D為Fe(OH)3,溶液C為硫酸銅溶液,經蒸發濃縮(或加熱蒸發、蒸發溶液),冷卻結晶、過濾,得到產品.
(1)堿式碳酸銅為堿式鹽能與稀硫酸反應,依據影響化學反應速率的因素分析判斷;
(2)雙氧水是一種綠色氧化劑,將Fe2+氧化為Fe3+;
(3)在溶液B中加CuO調節溶液的pH使Fe3+完全沉淀,且不引入新的雜質;
(4)依據溶度積常數計算氫氧根離子濃度,結合離子積常數計算氫離子濃度得到溶液PH;
(5)溶液中得到溶質的方法是經蒸發濃縮(或加熱蒸發、蒸發溶液),冷卻結晶、過濾,得到產品;
(6)Fe2+溶液與KMnO4溶液發生氧化還原反應,反應中MnO4-被還原為Mn2+,最小公倍數為5,所以KMnO4前系數為1,Fe2+前系數為5,結合原子守恒和電荷守恒配平寫出離子方程式,結合定量關系計算亞鐵離子濃度.
解答 解:孔雀石主要含Cu2(OH)2CO3,還含少量FeO、SiO2,向孔雀石中加入足量稀硫酸,發生的反應有Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑、FeO+H2SO4=FeSO4+H2O,SiO2和稀硫酸不反應,過濾得到固體SiO2,溶液A中含有含有亞鐵鹽及硫酸銅,氣體E為CO2,向溶液A中加入試劑①得到溶液B,試劑①是一種氧化劑,將Fe2+轉化為Fe3+且不能引進雜質,可選取雙氧水,向溶液B中加入CuO調節PH值使三價鐵離子沉淀,過濾得到D為Fe(OH)3,溶液C為硫酸銅溶液,經蒸發濃縮(或加熱蒸發、蒸發溶液),冷卻結晶、過濾,得到產品.
(1)堿式碳酸銅為堿式鹽能與稀硫酸反應:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,生成硫酸銅、水和二氧化碳,為了提高原料浸出速率,可采取的措施有增加硫酸濃度、將原料粉碎、提高反應溫度,加催化劑等,
故答案為:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;增加硫酸濃度;提高反應溫度;
(2)Fe2+具有還原性,雙氧水是一種綠色氧化劑,將Fe2+氧化為Fe3+,不產生污染物,也不引入雜質,只有c正確,
故答案為:c;
(3)在溶液B中加CuO調節溶液的pH使Fe3+完全沉淀,且不引入新的雜質,
故答案為:調pH值,(或減少c(H+),)使Fe3+沉淀完全;
(4)常溫下Fe(OH)3的Ksp=1×10-39,使溶液中c(Fe3+)=1×10-3mol/L,則c(OH-)=$\root{3}{\frac{1×1{0}^{-39}}{1×1{0}^{-3}}}$mol/L=1×10-12mol/L,所以溶液中c(H+)=1×10-2mol/L,則pH=2,
故答案為:2;
(5)CuSO4•5H2O晶體,在高溫時易失去水,所以從溶液中獲得CuSO4•5H2O晶體,需要經蒸發濃縮(或加熱蒸發、蒸發溶液),冷卻結晶、過濾,
故答案為:蒸發濃縮(或加熱蒸發、蒸發溶液);冷卻結晶;
(6)Fe2+溶液與KMnO4溶液發生氧化還原反應,反應中MnO4-被還原為Mn2+,最小公倍數為5,所以KMnO4前系數為1,Fe2+前系數為5,反應的離子方程式為MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,根據離子方程可知MnO4-~5Fe2+,用去KMnO4的物質的量為10.00×10-3L×0.010mol/L=1.0×10-4mol,所以A溶液中Fe2+濃度為$\frac{1.0×1{0}^{-4}mol×5}{0.02L}$=0.025mol/L,
故答案為:0.025.
點評 本題考查以孔雀石為主要原料制備CuSO4•5H2O,為高頻考點和常見題型,側重于學生的分析、實驗和計算能力得到考查,注意把握實驗的原理以及物質的性質,為解答該類題目的關鍵,注意掌握實驗基本操作和流程分析,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:多選題
| A. | 化學鍵的斷裂和形成是化學反應能量變化的主要原因 | |
| B. | 伴有能量變化的物質變化都是化學變化 | |
| C. | 在一個確定的化學反應中,反應物的總能量與生成物的總能量一定不同 | |
| D. | 在一個確定的化學反應中,反應物的總能量總是高于生成物的總能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氟化氫的電子式: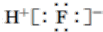 | B. | 中子數為21的鉀原子:${\;}_{19}^{40}$K | ||
| C. | NH3的結構式: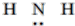 | D. | N3-的結構示意圖: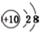 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=14的溶液 | |
| B. | c(OH-)=1.0×10-13mol•L-1的溶液 | |
| C. | 0.6%的醋酸(ρ=1g•cm-3) | |
| D. | pH=2的鹽酸與pH=12的氫氧化鋇溶液等體積混合后所得溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
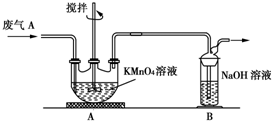 ①為了保證實驗成功,裝置A應具有的現象是KMnO4溶液的紫紅色不能完全褪色,攪拌的目的是提高SO2的吸收率.
①為了保證實驗成功,裝置A應具有的現象是KMnO4溶液的紫紅色不能完全褪色,攪拌的目的是提高SO2的吸收率.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com