
【題目】堿式碳酸銅可用作木材防腐劑、水體殺藻劑等,研究性學習小組設計以下方案制備堿式碳酸銅并進行相關實驗探究。
Ι.以銅屑為原料制備堿式碳酸銅的裝置如下:
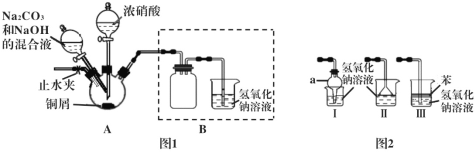
步驟1 連接好裝置,檢查裝置的氣密性,裝藥品。
步驟2 往三頸燒瓶中加入適量的濃硝酸,使銅屑完全反應。
步驟3 往步驟2反應后的溶液中加入一定比例的Na2CO3和NaOH的混合液,加熱。
步驟4 將三頸燒瓶中的混合物過濾、洗滌、烘干,獲得產物。
已知:ⅰ.堿式碳酸銅為草綠色或綠色結晶物,易溶于酸,不溶于水,在100℃的水中易分解;
ⅱ.NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O;
NO不能單獨與NaOH溶液反應。
(1)步驟2中濃硝酸與銅屑反應的離子方程式為___________________。
(2)步驟2反應一段時間后,須打開止水夾,通入一段時間的空氣,目的是_______。
(3)步驟3對裝置A的加熱方式最好采用____________。
(4)裝置Ι中儀器a的名稱為____,Ⅰ、Ⅱ、Ⅲ三個裝置不能替代圖1中B裝置的是_____(填裝置序號)。
(5)欲檢驗步驟4獲得的產物中是否含有NO3-,所需的試劑可以是__________。
Ⅱ.探究在一定溫度下,不同的原料配比對產物的影響,實驗數據如下:
實驗序號 | V[Cu(NO3)2] /mL (0.5 mo1·L-1) | V(NaOH) / mL (0.5 mo1·L-1) | V(Na2CO3)/ mL (0.25 mo1·L-1) | 沉淀數量 | 沉淀顏色 |
1 | 2.0 | 2.0 | 1.6 | + | 淺綠色 |
2 | 2.0 | 2.0 | 2.0 | + + | 淺綠色 |
3 | 2.0 | 2.0 | 2.4 | + + + | 藍色 |
4 | 2.0 | 2.0 | 2.8 | + + + | 藍色 |
注:“+”越多表示沉淀量越多
(6)分析表格數據可得:制備堿式碳酸銅最佳的原料配比n[Cu(NO3)2]:n(NaOH) : n(Na2CO3) =___。
Ⅲ.產物組成的測定
(7)堿式碳酸銅的成分有多種,化學式可表示為mCu(OH)2·n CuCO3。為測定Ι中所得堿式碳酸銅的組成,學習小組同學準確稱取3.820 g樣品溶于適量的硫酸中,加水配成l00 mL溶液,取l0.00 mL溶液于錐形瓶中,加適量水稀釋,調節溶液pH至3~4,加入過量的KI(2 Cu2+ + 4 I- = 2 CuI↓ + I2),用0.l000 mol·L-1 Na2S2O3標準溶液滴定(2 S2O32- + I2 = 2I- + S4O62-),接近終點時,加入淀粉指示劑,繼續滴定至終點,藍色消失。進行平行實驗后,測得平均消耗Na2S2O3標準溶液的體積為35.00 mL。該堿式碳酸銅的化學式為_____
【答案】Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑ + 2H2O 使裝置中有毒氣體被NaOH溶液完全吸收 水浴加熱 干燥管或球形干燥管 Ⅲ 硫酸、銅片(或其他合理答案) 2:2:1 4Cu(OH)2·3CuCO3
【解析】
Ι.(1)濃硝酸與銅反應生成硝酸銅、二氧化氮與水;
(2)反應一段時間后生成有毒的氣體氮氧化物,據此分析作答;
(3)依據給定的堿式碳酸銅的特性作答;
(4)根據儀器構造分析;B裝置需要防倒吸,據此考慮作答;
(5)硝酸根離子在酸性條件下具有氧化性,可與銅反應生成NO;
Ⅱ.(6)根據已知堿式碳酸銅的顏色結合實驗結果作答;
Ⅲ.(7)根據滴定過程中各物質的量之間的關系,列出關系式得出溶液中銅離子的物質的量,再結合質量列出方程組求出m和n的值得出結論。
Ι.(1)步驟2中濃硝酸與銅屑反應的離子方程式為Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑ + 2H2O;
(2)步驟2反應一段時間后,會生成有毒氣體二氧化氮(可能含NO),為了使氣體被氫氧化鈉充分吸收,須打開止水夾,通入一段時間的空氣,故答案為:使裝置中有毒氣體被NaOH溶液完全吸收;
(3)因堿式碳酸銅在100℃的水中易分解,所以步驟3對裝置A的加熱方式最好采用水浴加熱;
(4)裝置Ι中儀器a的名稱為干燥管或球形干燥管;裝置Ι中干燥管可防倒吸,裝置Ⅱ中倒置的漏斗也可起到防倒吸作用,裝置Ⅲ中苯的密度比水小,在水的上層,不能起到防倒吸作用,故答案為:Ⅲ;
(5)欲檢驗步驟4獲得的產物中是否含有NO3-,所需的試劑可以是硫酸、銅片(或其他合理答案);
Ⅱ.(6)堿式碳酸銅為草綠色或綠色結晶物,根據實驗數據可以看出,實驗2的沉淀量最多,實驗3和4得到的沉淀為藍色沉淀,則制備堿式碳酸銅最佳的原料配比n[Cu(NO3)2]:n(NaOH) : n(Na2CO3) =0.5mol/L:0.5 mol/L:0.25 mol/L =2:2:1;
Ⅲ.(7)由2Cu2++4I-═2CuI(白色)↓+I2、2S2O32-+I2═2I-+S4O62-可知,
反應的定量關系為:2Cu2+~I2 ~2S2O32-,所以n(Cu2+)=n(S2O32-)=0.100 0molL-1×0.03500L=3.5×10-3mol,
100mL溶液中含銅元素物質的量為3.5×10-3mol×![]() =3.5×10-2mol,則m+n=3.5×10-2mol,又樣品質量為3.820 g,所以98m+124n=3.820g,聯立方程可得m=0.020mol,n=0.015mol,所以m:n=4:3,故堿式碳酸銅的化學式可表示為:4Cu(OH)2·3CuCO3。
=3.5×10-2mol,則m+n=3.5×10-2mol,又樣品質量為3.820 g,所以98m+124n=3.820g,聯立方程可得m=0.020mol,n=0.015mol,所以m:n=4:3,故堿式碳酸銅的化學式可表示為:4Cu(OH)2·3CuCO3。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】在一定條件下,Na2CO3溶液中存在CO32-+H2O![]() HCO3-+OH-平衡。下列說法不正確的是
HCO3-+OH-平衡。下列說法不正確的是
A.稀釋溶液,[c(HCO3-)·c(OH-)]/c(CO32-)增大
B.通入CO2,溶液pH減小
C.升高溫度,平衡常數增大
D.加入NaOH固體,c(HCO3-)/c(CO32-)減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】B. [實驗化學]
乙酰苯胺具有退熱鎮痛作用,是較早使用的解熱鎮痛藥,有“退熱冰”之稱。其制備原理如下:

已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性質如下表:
物質 | 熔點 | 沸點 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
苯胺 | -6℃ | 184.4℃ | 3.4 |
醋酸 | 16.6℃ | 118℃ | 易溶 |
實驗步驟如下:
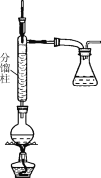
步驟1:在50 mL圓底燒瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少許鋅粉,依照如圖裝置組裝儀器。
步驟2:控制溫度計示數約105 ℃,小火加熱回流1 h。
步驟3:趁熱將反應混合物倒入盛有100 mL冷水的燒杯中,冷卻后抽濾,洗滌,得到粗產品。
(1)步驟1中加入鋅粉的作用是________。
(2)步驟2中控制溫度計示數約105℃的原因是________。
(3)步驟3中趁熱將混合物倒入盛有冷水的燒杯中,“趁熱”的原因是__________________。抽濾裝置所包含的儀器除減壓系統外,還有________、________(填儀器名稱)。
(4)步驟3得到的粗產品需進一步提純,該提純方法是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用微生物可實現苯酚(![]() )廢水的凈化,裝置如圖所示。下列有關說法正確的是
)廢水的凈化,裝置如圖所示。下列有關說法正確的是
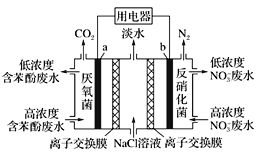
A. a極的電極反應式為:C6H5OH-28e-+11H2O=6CO2↑+28H+
B. b極為正極,發生氧化反應
C. 中間室的Na+向左室移動
D. 右室生成0.1 mol N2時,用電器流過0.5 mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過量排放含氮物質會污染大氣或水體,研究氮及其化合物的性質及轉化,對降低含氮物質的污染有著重大的意義。
Ⅰ.對NO與O2反應的研究。
(1)已知氮氧化物轉化過程中的焓的變化如下圖所示,寫出 NO轉化為NO2的熱化學方程式__________。
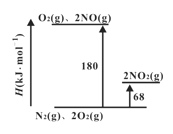
(2)2NO+O2![]() 2NO2的平衡常數表達式K=_______。其他條件不變,利用分子捕獲器適當減少反應容器中NO2的含量,平衡常數K將_____(填“增大”、“減小”或“不變” )。
2NO2的平衡常數表達式K=_______。其他條件不變,利用分子捕獲器適當減少反應容器中NO2的含量,平衡常數K將_____(填“增大”、“減小”或“不變” )。
(3)已知:2NO2(g)![]() N2O4(g) △H<0。在一定條件下,將2 mol NO和1 mol O2通入恒容密閉容器中進行反應,在不同溫度下,測得平衡時體系中NO、O2、NO2的物質的量與溫度的關系如下圖所示。
N2O4(g) △H<0。在一定條件下,將2 mol NO和1 mol O2通入恒容密閉容器中進行反應,在不同溫度下,測得平衡時體系中NO、O2、NO2的物質的量與溫度的關系如下圖所示。

①曲線c代表________的物質的量與溫度的關系,x點對應的O2的轉化率為________。
②根據上圖可推測_________________。
A.2NO+O2![]() 2NO2的平衡常數:x點﹥y點
2NO2的平衡常數:x點﹥y點
B.y點時2NO+O2![]() 2NO2的反應速率:υ(正)﹤υ(逆)
2NO2的反應速率:υ(正)﹤υ(逆)
C.400~1200℃時,隨著溫度升高,N2O4體積分數不斷增大
D.x點對應的NO的物質的量分數為4/11
Ⅱ.對廢水中過量氨氮轉化的研究。
廢水中過量的氨氮(NH3和NH4+)會導致水體富營養化。某科研小組用NaClO氧化法處理氨氮廢水,將其轉化為無污染物質,不同進水pH對氨氮去除率的影響如圖所示。
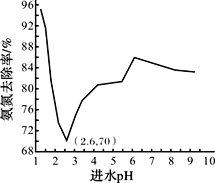
已知:ⅰ.HClO的氧化性比NaClO強;
ⅱ.NH3比NH4+更易被氧化。
(4)pH=1.25時,NaClO與NH4+反應生成N2等無污染物質,該反應的離子方程式______。
(5)進水pH為1.25~6.00范圍內,氨氮去除率隨pH升高發生圖中變化的原因是_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某密閉容器中發生如下反應:2X(g)+Y(g) ![]() 2Z(g) △H<0,下圖是表示該反應速率(v)隨時間(t)變化的關系圖。t1、t2、t5時刻外界條件均有改變(但都沒有改變各物質的用量)。則下列說法中正確的是
2Z(g) △H<0,下圖是表示該反應速率(v)隨時間(t)變化的關系圖。t1、t2、t5時刻外界條件均有改變(但都沒有改變各物質的用量)。則下列說法中正確的是
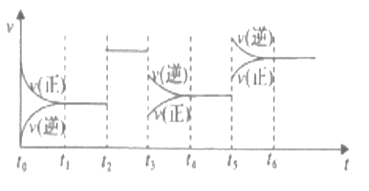
A. t6時刻后反應物的轉化率最低 B. t5時增大了壓強
C. t4時該反應的平衡常數小于t6時反應的平衡常數 D. t3時降低了溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CH4超干重整CO2技術可得到富含CO的化工原料。回答下列問題:
(1)CH4超干重整CO2的催化轉化如圖所示:

①已知相關反應的能量變化如圖所示:

過程Ⅰ的熱化學方程式為________。
②關于上述過程Ⅱ的說法不正確的是________(填序號)。
a.實現了含碳物質與含氫物質的分離
b.可表示為CO2+H2=H2O(g)+CO
c.CO未參與反應
d.Fe3O4、CaO為催化劑,降低了反應的ΔH
③其他條件不變,在不同催化劑(Ⅰ、Ⅱ、Ⅲ)作用下,反應CH4(g)+CO2(g)=2CO(g)+2H2(g)進行相同時間后,CH4的轉化率隨反應溫度的變化如圖所示。a點所代表的狀態________(填“是”或“不是”)平衡狀態;b點CH4的轉化率高于c點,原因是________。
(2)在一剛性密閉容器中,CH4和CO2的分壓分別為20kPa、25kPa,加入Ni/α-Al2O3催化劑并加熱至1123K使其發生反應CH4(g)+CO2(g)=2CO(g)+2H2(g)。

①研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某時刻測得p(CO)=20kPa,則p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
②達到平衡后測得體系壓強是起始時的1.8倍,則該反應的平衡常數的計算式為Kp=________(kPa)2。(用各物質的分壓代替物質的量濃度計算)
(3)CH4超干重整CO2得到的CO經偶聯反應可制得草酸(H2C2O4)。常溫下,向某濃度的草酸溶液中加入一定濃度的NaOH溶液,所得溶液中![]() ,則此時溶液的pH=________。(已知常溫下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
,則此時溶液的pH=________。(已知常溫下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于化學反應:N2(g)+O2(g)![]() 2NO(g),在密閉容器中,下列條件的改變引起該反應的反應速率的變化是什么(填在橫線上)。
2NO(g),在密閉容器中,下列條件的改變引起該反應的反應速率的變化是什么(填在橫線上)。
A.縮小體積使壓強增大______________________________________________________。
B.體積不變充入N2使壓強增大________________________________________________。
C.體積不變充入氬氣使壓強增大_______________________________________________。
D.壓強不變充入氬氣使體積增大_______________________________________________。
E.增大體積使壓強減小_______________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫恒容下,將2mol氣體A和2mol氣體B通入體積為2L的密閉容器中,發生如下反應:2A(g)+B(g)![]() xC(g)+2D(s),2min后反應達到平衡狀態,此時剩余1.2molB,并測得C的濃度為1.2mol/L。
xC(g)+2D(s),2min后反應達到平衡狀態,此時剩余1.2molB,并測得C的濃度為1.2mol/L。
(1)從開始反應至達到平衡狀態,生成C的平均反應速率為__。
(2)x=__。
(3)下列各項可作為該反應達到平衡狀態的標志是__(填字母)。
A.氣體密度不再變化
B.壓強不再變化
C.A的消耗速率與B的消耗速率之比為2:1
D.氣體平均相對分子質量不再變化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com